
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уровень b
|
|
|
|
В каждой реакции вычислить молярную массу эквивалента гидроксида железа (III). В одной из реакций определить массу гидроксида железа (III), необходимую для взаимодействия с 3,65 г хлороводородной кислоты.

| РЕШЕНИЕ:
Мэк (основ.) = 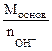 , г/моль , г/моль
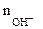 - число гидроксогрупп,
замещенных в данной реакции на кислотный остаток.
По реакциям а), б) и в):
Определяем - число гидроксогрупп,
замещенных в данной реакции на кислотный остаток.
По реакциям а), б) и в):
Определяем 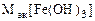
|
а) HCl + Fe(OH)3 = Fe(OH)2Cl + H2O
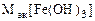 =
= 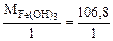 = 106,8 г/моль
= 106,8 г/моль
б) 2HCl + Fe(OH)3 = FeOHCl2 + 2H2O
Mэк[Fe(OH)3] = 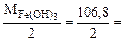 53,4 г/моль
53,4 г/моль
в) 3HCl + Fe(OH)3 = FeCl3 + 3H2O
Mэк[Fe(OH)3] =  35,6 г/моль.
35,6 г/моль.
По закону эквивалентов:
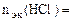
 , т.е.
, т.е. 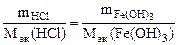
Откуда по реакции (в)

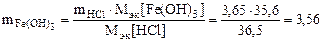 г,
г,
где Mэк[Fe(OH)3] = 35,6 г,моль
Ответ:а)Mэк[Fe(OH)3] = 106,8 г/моль
б) Mэк[Fe(OH)3] = 53,4 г/моль
в) Mэк[Fe(OH)3] = 35,6 г/моль.
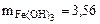 г.
г.
 3. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРА
3. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРА
1. Плотность 6% водного раствора ортофосфорной кислоты равна 1,031 г/см3. Рассчитать:
а) молярную концентрацию;
б) моляльность;
в) молярную долю кислоты в растворе.
Дано:
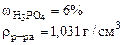
| РЕШЕНИЕ:
а) Молярную концентрацию кислоты определяем по формуле:
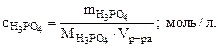
|
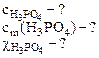
|
Согласно условию задачи в 100 г раствора содержится 6 г
Н3РО4. Тогда 6 г Н3РО4 содержится в объеме раствора
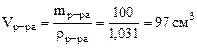 ;
;
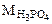 = 1·3 +31+16·4 =98 г/моль
= 1·3 +31+16·4 =98 г/моль
Следовательно, 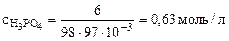 ,
,
где 10-3 - пересчет см3 в л.
б) моляльность кислоты в растворе определяем по формуле:
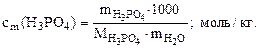

Тогда 
где 1000 - коэффициент пересчета г в кг.
в) молярную долю кислоты определяют по формуле:
 = =
= =  = 0,011
= 0,011



2. Определить объем 16%-ного раствора карбоната калия плотностью 1,149 г/см3, необходимого для приготовления 3 л 0,2 М водного раствора данного вещества. Пояснить процесс приготовления раствора.
Дано:

| РЕШЕНИЕ:
а) Молярную концентрацию карбоната калия определяем по формуле:
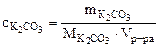
|
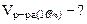
|
Следовательно:
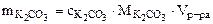

 = 2·39 + 12 +16·3 =138 г/моль
= 2·39 + 12 +16·3 =138 г/моль

Рассчитываем массу 16%-ного раствора К2СО3, который содержит 82,8 г К2СО3.
Составляем пропорцию:
100 г р-ра - 16 г К2СО3
mр-ра(16%) - 82,8 г К2СО3.
mр-ра(16%) =  517,5 г,
517,5 г,
Определим объём 16% - ного раствора:
 450,4 см3
450,4 см3
Ответ: для приготовления 3 л 0,2 М раствора К2СО3 нужно взять 450,4 мл 16%-ного раствора К2СО3 и разбавить его водой до 3 л.
3. Найти массы воды и кристаллогидрата CuSO4·5H2O, необходимые для приготовления 2 литра раствора, содержащего 8% мас. безводной соли. Плотность 8%-го раствора CuSO4 равна 1,084 г/см3.
Дано:
Vр-ра = 2 л
ω  = 8%
ρр-ра= 1,084 г/см3 = 8%
ρр-ра= 1,084 г/см3
| РЕШЕНИЕ
Массу безводной соли (CuSO4), необходимую для приготовления заданного раствора определяем из формулы:
ω  = =  , % , %
|

|
откуда 
Масса раствора равна

 , где 103 коэффициент перевода л в см3. Тогда масса CuSO4 в растворе составляет:
, где 103 коэффициент перевода л в см3. Тогда масса CuSO4 в растворе составляет:
 ,
,
Массу CuSO4·5H2O, содержащую 86,7 г CuSO4, определяем из пропорции:
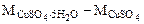 250 г/моль -160 г/моль
250 г/моль -160 г/моль 
 - 173,4 г
- 173,4 г
где
 = 64+32+16·4=160 г/моль
= 64+32+16·4=160 г/моль
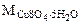 = 64+32+16·4 +5·(1·2+16)=250 г/моль
= 64+32+16·4 +5·(1·2+16)=250 г/моль
Тогда

Зная массу раствора и кристаллогидрата, определяем массу воды, необходимую для приготовления заданного раствора:

Ответ: 
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 300; Нарушение авторских прав?; Мы поможем в написании вашей работы!
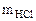 = 3,65 г
Fe(OH)3
Mэк[Fe(OH)3] -?
= 3,65 г
Fe(OH)3
Mэк[Fe(OH)3] -?
