
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уровень B. 1. Найти массу метана (СН4), при полном сгорании которого до со2(г) и н2о(г) в тепловом агрегате выделяется теплота
|
|
|
|
ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
1. Найти массу метана (СН4), при полном сгорании которого до СО2(г) и Н2О(г) в тепловом агрегате выделяется теплота, достаточная для нагревания 1 л воды от 20 до 100оС. Мольную теплоемкость воды принять равной 75,3 Дж/моль·К. КПД теплового агрегата составляет 50%.
Дано:
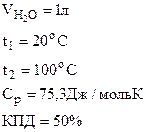
|
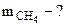
|
РЕШЕНИЕ:
Количество теплоты, необходимое
для нагревания 1 л (1000 г) воды от
20 до 100оС определяем по формуле:
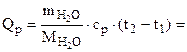

= 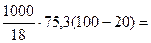
= 334666,7 Дж = 334,7 кДж
Определим массу метана при горении, которого выделяется такое количество теплоты. Процесс горения метана по условию задачи описывается уравнением:
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г)
Тепловой эффект этой реакции Dr.Ho(298K) определяем по I следствию из закона Гесса
Dr.Ho(298K) = Df.Ho(298K,CO2(г)) + 2Df.Ho(298K, Н2О(г)) -
- Df.Ho(298K, CН4(г)) - 2Df.Ho(298K, О2(г)) = (-393,5) + 2(-241,8) –
- (-74,9) = - 802,2 кДж
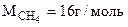
Таким образом при сгорании 16 г метана выделяется 802,2 кДж тепла. Определяем массу метана, при сгорании которой выделяется 334,7 кДж теплоты. Составляем пропорцию:
16 г СН4 ― 802,2 кДж
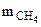 ― 334,7 кДж
― 334,7 кДж
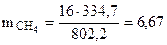 г
г
С учетом КПД теплового агрегата масса метана составляет
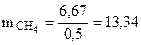 г
г
Ответ: масса метана составляет 13,34 г.
2. Используя справочные данные по DfHo(298K, В) и So(298K, В), определить при каких температурных условиях возможно самопроизвольное протекание реакции
Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2O(г)
| Дано: Уравнения реакции |
| DrGо(298К)-? условия протекания реакции -? |
РЕШЕНИЕ:
Возможность самопроизвольного протекания реакции, определяется знаком перед величиной изменения энергии Гиббса для данной реакции:
если ΔrG°(298К) < 0, самопроизвольное протекание реакции при стандартных условиях возможно в прямом направлении;
если ΔrG°(298К) > 0, то при стандартных условиях прямая реакция невозможна, а возможна обратная реакция..
Значение ΔrG°(298К) рассчитываем по формуле:
ΔrG°(298К) = ΔrН°(298К)·103 - Т ΔrS°(298К)
где ΔrН°(298К) - изменение стандартной энтальпии реакции, кДж: ΔrS°(298К) - изменение стандартной энтропии реакции, Дж/К:
103 - пересчет кДж в Дж.
Значение ΔrН°(298К) и ΔrS°(298К) определяем согласно первому следствию из закона Гесса:
ΔrН°(298К) = [2ΔfН°(298К, Fe(к)) + 3ΔfН°(298К, Н2О(г))] –
- [ΔfН°(298К, Fe2O3(к)) + 3ΔfН°(298К, Н2(г))];
ΔrS°(298К) = [2S°(298К, Fe(к)) + 3S°(298К, Н2О(г))] –
- [S°(298К, Fe2O3(к)) + 3S°(298К, Н2(г))];
где ΔfН°(298К, В) и S°(298К, В) - стандартные энтальпии образования и энтропии веществ, значения которых находим из таблицы стандартных термодинамических величин.
| Fe2O3(к) + | 3Н2(г) | = 2Fe(к) | + 3Н2О(г) | |
| DfHo(298K), кДж/моль | 1(-822,2) | 3(0) | 2(0) | 3(-241,84) |
| So(298 K), Дж/(моль×К) | 1(87,4) | 3(130.5) | 2 (27.15) | 3(188,74) |
ΔrН°(298К) = [2(0) + 3(-241,84)] - [(-822,2) + 3(0)] = 96,68 кДж
ΔrS°(298К) = [2·27,15 + 3·188,74] - [87,4 + 3·130,5] = 141,62 Дж/К
тогда:
ΔrGо(Т) = 96680 - Т·141,62
Ответ: При высоких температурах значение ΔrGо(Т) < 0 и, следовательно, реакция возможна при нагреве.
3. Рассчитать теплотворную способность каменного угля, если известно, что в нем содержится 80% углерода, а в отходящих газах после сгорания угля содержится 14% СО2 и 2% СО по объему.
Дано:
ωC = 80% масс.
ω 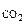 = 14% об.
ω = 14% об.
ω 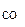 = 2 % об. = 2 % об.
|
| Qкаменного угля -? |
РЕШЕНИЕ:
Теплотворной способностью топлива называется тепловой эффект, который соответствует сгоранию единицы массы (1 кг) для твердых и жидких видов топлив (Qр, кДж/кг).
Приводим уравнения горения углерода
С(к) + О2(г) = СО2(г) (4.8)
С(к) + ½ О2(г) = СО(г) (4.9)
Из приведенных уравнений (ур. 4.8 и 4.9) следует, что масса сгоревшего углерода пропорционально объемам образовавшихся газов. Поскольку в каменном угле содержится 80% углерода, то в 1000 г каменного угля содержится 800 г углерода и в СО2 превратилось (ур 4.8)
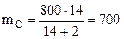 г углерода,
г углерода,
а в СО превратилось: 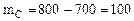 г углерода (ур. 4.8)
г углерода (ур. 4.8)
Исходя из того, что тепловые эффекты реакций (4.8) и (4.9) есть стандартные энтальпии образования СО2 и СО (величины табличные), но взятые с противоположным знаком, поскольку DН= - Qр
DfНo(298 K, СО2) = - 393,5 кДж/моль
и DfНo(298 K, СО) = - 110,5 кДж/моль
рассчитываем количество теплоты, выделившейся при сгорании 700 г углерода до СО2 (ур. 4.8). Молярная масса углерода
МС = 12 г/моль.
При сгорании
12 г углерода выделяется 393,5 кДж
700 г углерода выделяется Qр(4.8) кДж
откуда:
Qр(4.7) 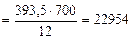 кДж
кДж
Рассчитываем количество теплоты, выделившейся при сгорании 100 г углерода до СО (ур.4.9).
при сгорании
12 г углерода выделяется 110,5 кДж
100 г углерода выделяется Qр(4.9) кДж
откуда:
Qр(4.9)  кДж
кДж
Следовательно теплотворная способность каменного угля
Qр = Qр(4.8) + Qр(4.9) = 22954 + 921 = 23875 кДж/кг
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 903; Нарушение авторских прав?; Мы поможем в написании вашей работы!