
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Властивості елементів II групи
|
|
|
|
Лабораторна робота № 14
Мета роботи: Ознайомитись з властивостями елементів другої групи: способами їх отримання, характерними валентностями, хімічними властивостями елементів та їх основних сполук. Визначити особливості поведінки Меркурію та його біохімічною роллю. Ознайомитися з поняттям твердість води та способами їх визначення.
s-елементи ІІ групи (лужноземельні метали)
Дослід 1. Взаємодія магнію з водою.
Поверхню магнієвої стрічки очистити наждачним папером від оксиду. У пробірку налити 5-6 крапель дистильованої води і занурити в неї очищений магній. Чи спостерігається перебіг реакції при кімнатній температурі? Нагріти пробірку невеликим полум'ям пальника. Що спостерігається? Додати до одержаного розчину одну краплину розчину фенолфталеїну. Описати те, що відбувається. Скласти рівняння реакції.
Дослід 2. Взаємодія магнію з кислотами.
У дві пробірки покласти шматочок магнієвої стрічки. В першу пробірку внести кілька краплин 2 н розчину соляної кислоти, у другу – таку саму кількість 2 н розчину азотної кислоти. Записати рівняння реакцій.
Дослід 3. Визначення твердості води.
1. Визначення тимчасової твердості води. У конічну колбу для титрування відміряти 100 мл води, що підлягає дослідженню. Додати 2-3 краплини індикатора - метилового оранжевого. У бюретку налити 0,1 н титрований розчин хлоридної кислоти та встановити рівень на нульову відмітку. При ретельному перемішуванні по краплинах додавати з бюретки кислоту у колбу зі зразком води до зміни забарвлення індикатора від жовтого до жовтогаряче-рожевого. Визначити об'єм використаної на титрування хлоридної кислоти. Повторити титрування 2 рази. Розходження в об'ємі кислоти при титруванні не повинно перебільшувати 0,05 мл. Тимчасову твердість води обчислити за формулою, мекв/ л:
T = 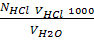 ,
,
де NHCl – нормальна концентрація HCl; VHCl - об'єм HCl, використаної на титрування, мл; VH2O – об'єм води, взятої для дослідження, мл; 1000 – коефіцієнт для переходу до міліеквіалентів на літр.
2. Визначення загальної твердості води. У конічну колбу відміряти 100 мл водопровідної води. Долити 5 мл лужного буферного розчину. Останній готують,змішуючи 100 мл 20%-го розчину NH4OHі 100 мл 20%-го розчину NH4Cl. Всипати кілька кристалів індикатора хромоген чорного до одержання помітного бузкового забарвлення. Потім від титрувати робочим 0,1 н розчином трилону Б до зміни забарвлення в синє. Обчислити
Т= 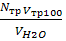 ,
,
де Nтр- нормальність розчину трилону Б; Vтр - об'єм розчину трилону Б, використаного на титрування води, мл; VH2O - об'єм води, взятої для титрування, мл. За тимчасовою та загальною твердістю води можна визначити постійну твердість води: Тпост = Тз - Ттимч
Завдання та запитання для самопідготовки
1. Як Берилій, Магній і лужноземельні метали відносяться до води, кисню, кислот і лугів?
2. Скласти рівняння реакцій окиснення Кальцію розбавленими і концентрованими кислотами HNO3 і H2SO4.
3. Чому Магній, що горить не можна гасити водою?
4. Визначити твердість води, у 10 л якої вміщується 6г. CaCl2.
Відповідь: 10,81 мекв/л.
5. Що таке магнезіальний цемент?
6. Скільки карбонату натрію треба додати до 5л. води, щоб усунути загальну твердість, що дорівнює 4,6 мекв/л?
7. При кип'ятінні 250 мл води, що містить гідрокарбонат кальцію, випав осад масою 3,5 мг. Чому дорівнює твердість води?
8. Закінчити рівняння реакцій:
Be + HNO3(p) → Ba + HNO3(p) →
Be + KOH + H2O → Ba(NO3)2 →t
BeO + KOH → CaH2 + H2O →
MgO + C →t Ca(OH)2 + SiO2 →
CaC2 + H2O → Ca3N2 + H2O →
BaO2 + FeSO4 + H2SO4 → Ca(HCO3)2 + HCl →
Mg3C2 + H2O → BaO2 + H2SO4 →
Mg + C →
d-елементи ІІ групи (елементи підгрупи Цинку)
Дослід 4. Розчинення цинку в кислотах і лугах.
У пробірку покласти шматочок цинку і додати 4-5 крапель 2 н рочину сульфатної кислоти і нагріти. Спостерігати виділення водню. Те саме зробити із концентрованою сульфатною кислотою і за запахом визначити виділення сірчистого газу. Чому розбавлена і концентрована кислота по різному взаємодіють з цинком?
Так само переірити розчинність цинку в 2 н розчинах хлоридної кислоти та їдкого лугу. Скласти рівняння реакцій.
Дослід 5. Властивості цинку.
Покласти у фарфоровий тигельок трохи цинкового пилу, додати 4 краплини 0,5 н розчину калій нітрату і 4-5 краплин концентрованого розчину їдкого лугу. Визначити за запахом виділення амонію. Червоний лакмусовий папірець, змочений водою, стає синім. Записати рівняння реакцій в молекулярному та іонному вигляді.
Дослід 6. Гідроксиди цинку і кадмію та їх ластивості.
У дві пробірки налити по 4 краплини розчину солі цинку, у дві інші – стільки само розчину кадмію. Додати у кожну пробірку краплинами 2 н розчин їдкого лугу до появи білих драглеподібних осадів гідроксидів. Подіяти на одержані гідроксиди кислотами і лугами. Зробити висновок про кислотно-основні властивості гідроксидів цинку і кадмію. Записати рівняння реакцій у молекулярній та іонній формі.
Дослід 7. Взаємодія солей Меркурію з лугами.
У першу пробірку внести 3 краплини розчину меркурію (II) нітрату, у другу – 3 краплини розчину меркурію (I) нітрату. До кожного розчину додати по 2 краплини 2 н розчину лугу і спостерігати випадіння першій пробірці меркурію (I) оксиду HgO, у другій – суміші продуктів диспропорціонування меркурію (I) оксиду: меркурію (II) оксиду і металічного меркурію. Відмітити колір осадів і написати рівняння реакцій.
Дослід 8. Окисні властивості солей Меркурію.
Налити в пробірку2 краплини розчину меркурію (II) нітрату і додати 3 краплини 0,5 н розчину хлориду олова. Після додавання першої краплини спостерігати появу білого осаду каломелі HgCl2. Через 3-4 хв осад темніє. Чому? Написати рівняння реакцій.
Завдання та запитання для самопідготовки
1. Написати рівняння реакцій розчинення цинку в розбавлених і концентрованих кислотах HNO3 і H2SO4.
2. Розчин меркурію (II)нітрату обробити надлишком калію йодиду. Що при цьому утвориться? Написати рівняння реакції
3. Написати рівняння реакцій, які проходять, якщо добавити до розчину, що містить іони Zn2+ , Cd2+,Hg2+:а) надлишок лугу;б)надлишок розчину амоніаку.
4. За допомогою яких реакцій можна розділити іони, які містяться розчині: а) Zn2+ , Cd2+,Hg2+ і Hg2 1+?
5. Скласти рівняння реакцій розчинення Меркурію в концентрованій азотній кислоті: а) надлишку; б) недостачі.
6. На яких властивостях ґрунтується очищення Меркурію від домішок Цинку і Олова при обробленні розчином Меркурій нітрату? Написати рівняння реакцій.
7. Закінчити рівняння реакцій:
Zn + KOH + H2O → HgCl2 + SnCl2 →
ZnS + O2 →t Hg + HgSO4 + NaCl →
Zn(OH)2 + NH4OH → SO2 + HgCl2 + H2O →
ZnO + NaOH + H2O → HgS + HNO3 + HCl →
Zn + NaNO3 + NaOH → NH3 HgCl2 + NH4OHконц →
Cd(NO3)2 →t Hg(NO3)2 →t
CdSO4 + NaOH → HgCl2 + Ba(OH)2 →
Hg + HNO3 + HCl → HgCl2 + HCl →
HgS + O2 → HgCl2 + KJ(надл) →
HgCl2 + H2O →
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 722; Нарушение авторских прав?; Мы поможем в написании вашей работы!