
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Мера химического сродства
|
|
|
|
Химическое сродство.
Химической реакции
Уравнение максимальной работы
Химический потенциал. Уравнение максимальной работы химической реакции (уравнение Гиббса –Гельмгольца). Химическое сродство. Константа равновесия и максимальная работа реакции. Зависимость константы равновесия от давления и температуры. Тепловая температура Нернста. Стандартные значения термодинамических функций веществ.
По теме не предусмотрены практические занятия, лабораторные и контрольные работы.
После изучения теоретического материалы следует ответить на вопросы для самопроверки по этой теме. Ответы можно найти в учебниках [1,3].
Причиной реакции является химическое сродство реагирующих веществ, т.е. сила их стремления к соединению.
За меру химического сродства принимается максимальная работа реакции, величина которой для реакции 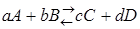 может быть определена по следующим уравнениям:
может быть определена по следующим уравнениям:
При v, Т = const

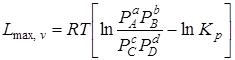 . (6.16)
. (6.16)
При р, Т = const
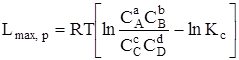
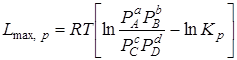 , (6.17)
, (6.17)
где С –начальные концентрации; Р –начальные парциальные давления соответствующих газов.
Эти уравнения позволяют решить вопросы о возможности осуществления реакции при заданных условиях и о направлении реакции. Для этого следует сравнить значение  , вычисленное по заданным начальным концентрациям веществ, со значением константы равновесия Кс, взятым из таблиц для рассматриваемой реакции при заданных условиях.
, вычисленное по заданным начальным концентрациям веществ, со значением константы равновесия Кс, взятым из таблиц для рассматриваемой реакции при заданных условиях.
Если  > Kc, т.е. L max > 0, то при заданных условиях возможна прямая реакция превращения веществ А и В, в вещества С и D.
> Kc, т.е. L max > 0, то при заданных условиях возможна прямая реакция превращения веществ А и В, в вещества С и D.
Если  < Kc, т.е. L max < 0, то при заданных условиях невозможна прямая реакция соединения веществ А и В, а возможна только обратная реакция –распада веществ С и D на вещества А и В. Если L max = 0, то это означает, что при заданных условиях невозможны ни прямая, ни обратная реакции, так как при этих условиях система находится в химическом равновесии.
< Kc, т.е. L max < 0, то при заданных условиях невозможна прямая реакция соединения веществ А и В, а возможна только обратная реакция –распада веществ С и D на вещества А и В. Если L max = 0, то это означает, что при заданных условиях невозможны ни прямая, ни обратная реакции, так как при этих условиях система находится в химическом равновесии.
Ввиду того, что максимальная работа одной и той же реакции при одной и той же температуре есть величина переменная, зависящая от начальных концентраций веществ, для оценки химического сродства максимальные работы различных реакций берутся при начальных концентрациях всех веществ, равных единице. При этом

 ,
,
 .
.
 (6.18)
(6.18)
Последнее уравнение может быть применено для вычисления уменьшения свободной энергии и термодинамического потенциала, так как
 ;
;  ;
;
при этом
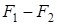
 =
= 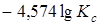
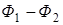
 =
= 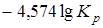 .
.
Закон Нернста (тепловая теорема). Согласно закону Нернста вблизи абсолютного нуля в реакциях, протекающих в конденсированных системах, равны максимальные работы и тепловые эффекты:
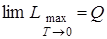 ,
,
а также
 . (6.19)
. (6.19)
По закону Нернста постоянная интегрирования в уравнениях константы равновесия и максимальной работы для конденсированных систем равна нулю.
Следствие тепловой теоремы:
1. При абсолютном нуле теплоемкость сi конденсированных тел равна нулю:
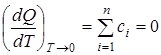 .
.
Опытные данные позволяют предположить, что при абсолютном нуле не только алгебраическая сумма теплоемкостей, но и теплоемкость каждого тела в отдельности равна нулю.
2. При абсолютном нуле энтропия конденсированных тел равна нулю:
 .
.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 719; Нарушение авторских прав?; Мы поможем в написании вашей работы!