
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. Необходимо найти: p1, t2, V2, L
|
|
|
|
Дано: V1, mсм, p2, t1,  ,
,  ,
,  .
.
Необходимо найти: p1, t2, V2, L1-2, Δ U=U2–U1.
1. Сначала схематично представим рассматриваемый процесс в pv - и Ts - диаграммах, следуя рис. 4.1.
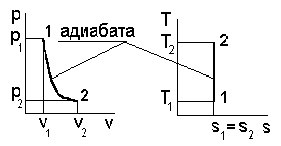
Рис. 4.1
2. Состояние исследуемой газовой смеси описывается уравнением Клапейрона - Менделеева (см. формулу 1), которое в обозначениях, принятых в данной задаче, можно представить в виде
p·V=mсм·Rсм·T. (4.1)
Газовая смесь из состояния 1 переходит в состояние 2 по адиабате, поэтому параметры начального и конечного состояний смеси связаны с уравнениями (1.59, 1.60, 1.61). Применительно ко всему объему (Vi=mсм·vi) эти уравнения принимают вид
p1 · 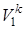 = p2 ·
= p2 ·  ; T1·
; T1· 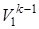 = T2·
= T2· 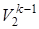 ; T1k ·
; T1k ·  = T2k ·
= T2k ·  . (4.2)
. (4.2)
Из структуры формулы (4.1) следует, что, в начале необходимо определить газовую постоянную смеси Rсм. Для этого используем формулу (1.18):

Анализ процесса сжатия смеси осуществляется при помощи уравнений (4.2), но прежде необходимо найти показатель адиабаты  , для нахождения значения которого нужно рассчитать изобарную cpсм и изохорную cvсм теплоемкости смеси, используя формулы (1.22,1.21):
, для нахождения значения которого нужно рассчитать изобарную cpсм и изохорную cvсм теплоемкости смеси, используя формулы (1.22,1.21):
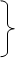

. (4.3)

По условию рассматриваемой задачи смесь задана объемными долями ri, а в формулах (4.3) состав смеси выражен в массовых долях γi. Перевод в массовые доли производим при помощи формулы (1.19):
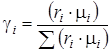 .
.
 .
.
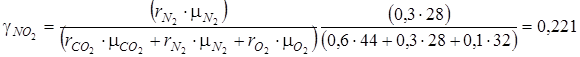 .
.
 .
.
Из [П.1] находим значения мольных изобарных и изохорных теплоемкостей компонентов газовой смеси
 = 37,4;
= 37,4; 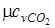 = 29,1
= 29,1
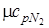 = 29,1;
= 29,1;  = 20,8
= 20,8
 = 29,1;
= 29,1; 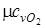 = 20,8
= 20,8
Переводим значения мольных теплоемкостей в массовые с помощью формул:
 ;
; 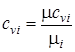
 ;
;
 ;
;
 ;
;
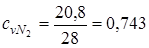 ;
;
 ;
;
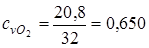 .
.
Найденные массовые доли компонентов газовой смеси γi и их изобарные, изохорные теплоемкости подставляем в уравнения (4.3):
cpсм =0,695·0,85+0,221·1,039+0,084·0,909=0,8967.
cvсм =0,695·0,66+0,221·1,743+0,084·0,650=0,6775.
Определяем значение показателя адиабаты:
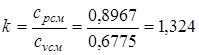 .
.
Формулу (4.1) напишем применительно к начальному состоянию смеси
р1V1=mсм ·R см ·T1,
где T1=t1 +273.
Из последнего выражения находим начальное давление:
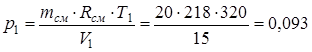 .
.
Далее в соответствии с первой из формул (4.2) p1 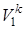 =p2
=p2  определяем конечный объем смеси:
определяем конечный объем смеси:
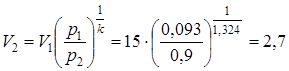 .
.
Пользуясь второй из формул (4.2) T1 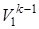 =T2
=T2 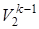 , рассчитываем конечную температуру смеси:
, рассчитываем конечную температуру смеси:
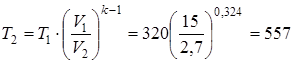 .
.
 .
.
Обращаясь к формуле (1.63), находим удельную работу сжатия газовой смеси:
 .
.
Применительно ко всей массе смеси работа сжатия равна
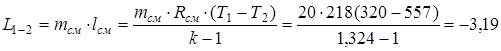 .
.
Отрицательное значение L1-2 означает, что эта работа внешних сил над газовой смесью.
Изменение удельной внутренней энергии смеси определяем, используя формулу (1.64)
Δ u =(u2-u1)= cv·(T2-T1).
Применительно ко всей массе смеси изменение внутренней энергии равно
Δ U = U2-U1=mсм ·(u2-u1)=mсм ·cv·(T2-T1)=
= 20·0,6775(557-320)=3,19.
Определяем парциальные давления компонентов газовой смеси. Из закона Бойля - Мариотта следует
 .
.
Используя последнее выражение, определяем парциальные давления компонентов газовой смеси:
 =
=  · p2 =0,6·0,9=0,54,
· p2 =0,6·0,9=0,54,
 =
=  · p2 =0,3·0,9=0,27,
· p2 =0,3·0,9=0,27,
 =
=  · p2 =0,1·0,9=0,09.
· p2 =0,1·0,9=0,09.
Пример 2. Рассчитать цикл ДВС с изохорным подводом теплоты (цикл Отто), если начальные параметры рабочего тела p1 =0,1 МПа, t1 =20 ˚C, степень сжатия ε=6,5, а отведенная теплота | q2 |=320 кДж/кг. Определить параметры состояния рабочего тела в характерных точках цикла, подведенное количество теплоты q1, работу цикла lц и термический КПД η t, а также термический КПД цикла Карно в том же диапазоне температур. Изобразить цикл в координатах p, v и T, s. Рабочее тело - воздух. Средняя изохорная теплоемкость
cvm =0,716 кДж/(кг·К); удельная газовая постоянная Rв =287 Дж/(кг·К); показатель адиабаты k =1,4.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1351; Нарушение авторских прав?; Мы поможем в написании вашей работы!