
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физико-химические основы горения топлива
|
|
|
|
Основу горения составляет реакция окисления. Для протекания химической реакции между горючими веществами топлива и окислителями необходимо создать:
1. Химический контакт между молекулами веществ (осуществляется при образовании горючей смеси).
2. Довести молекулы до такого состояния, при котором становятся возможны химические реакции между ними.
Интенсивность горения газа и паров жидкого топлива выражается количеством горючего, сгоревшего в единице объема за единицу времени.
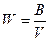 Интенсивность горения жидкого и газообразного топлива определяется по формуле:
Интенсивность горения жидкого и газообразного топлива определяется по формуле:
где V – объем реагирующей смеси (объем факела), м3; B – расход горючего, кг/с, м3/с.
 Интенсивность горения твердого топлива определяется по формуле:
Интенсивность горения твердого топлива определяется по формуле:
где S – площадь реагирующей поверхности, м2.
В промышленных установках интенсивность горения в камерной топке оценивается по величине удельного тепловыделения.
, [кДж/м3.с] 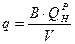
В реальных условиях интенсивность горения определяется по скорости горения исходных веществ. Что зависит не только от скорости протекания химической реакции, но и от скорости процесса смесеобразования.
Горящая частица считается окруженной пограничной плёнкой, в пределах которой происходит догорание окиси углерода, а перенос вещества осуществляется только за счет молекулярной диффузии. В пределах плёнки происходит изменение концентрации веществ и температуры. За её пределами в основном потоке, окружающем частицу, имеет интенсивный турбулентный массоперенос. В связи с этим основной поток считается однородным. В результате можно принять, что концентрации кислорода в объёме основного потока и на поверхности пограничной плёнки равны.
Различают кинетическую и диффузионную области горения.
Кинетической называется область горения, в которой скорость процесса горения ограничена только скоростью химического реагирования на поверхности (скоростью химической реакции).
Диффузионной называется область горения, если скорость горения не зависит от скорости реакции и ограничена только скоростью процесса смесеобразования.
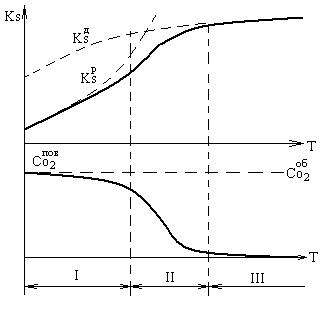
Рисунок 1.5 – Области горения частицы постоянного размера и изменения концентрации кислорода у поверхности:
I – кинетическая область; II – переходная область; III – диффузионная область;
Собо2 – концентрация кислорода в объеме основного потока; Спово2 – концентрация кислорода на поверхности частицы; Ks – скорость химической реакции (д – кислорода, диффундирующего через пограничную пленку; р – на единице поверхности).
При относительно невысоких температурах (1000 оС для коксовых частиц) реакция на поверхности протекает достаточно медленно, и потребление кислорода меньше его возможной доставки к поверхности (кинетическая область – I). То есть здесь процесс горения не зависит от условия подвода кислорода.
При высоких температурах процесса (выше 1400 оС) доставляемый диффузией к поверхности кислород мгновенно вступает в реакцию, в результате чего его концентрация у поверхности становится практически равной нулю (диффузионная область – III). В этой зоне, не смотря на рост температуры, скорость реакции изменяется медленно. Здесь реакция могла бы идти со значительно большей скоростью, но она сдерживается недостаточным подводом кислорода.
В зоне промежуточных температур (1000-1400 оС) скорость химической реакции на поверхности становится соизмеримой со скоростью доставки кислорода и тогда общая скорость реакции определяется обоими процессами. Ее расположение по шкале температур зависит от размера горящих частиц: чем меньше размер частицы, тем при более высокой температуре начинается переходная область.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1006; Нарушение авторских прав?; Мы поможем в написании вашей работы!