
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость скорости химической реакции от температуры
|
|
|
|
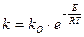 С увеличением температуры скорость химической реакции горения возрастает. Для нахождения зависимости скорости химической реакции от температуры достаточно определить температурную зависимость константы. Эта зависимость выражается законом Аррениуса.
С увеличением температуры скорость химической реакции горения возрастает. Для нахождения зависимости скорости химической реакции от температуры достаточно определить температурную зависимость константы. Эта зависимость выражается законом Аррениуса.
где Е – энергия активации (кДж/моль), R – газовая постоянная (8,314 кДж/моль), kо – предэкспоненциальный множитель (общее число столкновений молекул), Т – абсолютная температура процесса.
Энергия достаточная для разрушения внутримолекулярных связей исходных веществ, называется энергией активации Е. Чем выше уровень энергии активации, тем медленнее скорость реакции.
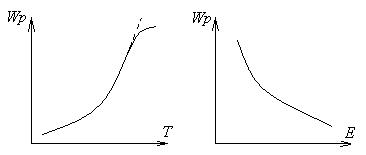 Так, энергия активации реакции С+О2=СО2 – ЕСО2=140 кДж/моль, а реакции С+1/2О2=СО –Есо=60 кДж/моль. Отсюда следует, что в реакции окисления углерода кислородом скорость образования окиси углерода СО значительно выше, чем образования двуокиси СО2, и количество СО у поверхности горящего углерода будет преобладать.
Так, энергия активации реакции С+О2=СО2 – ЕСО2=140 кДж/моль, а реакции С+1/2О2=СО –Есо=60 кДж/моль. Отсюда следует, что в реакции окисления углерода кислородом скорость образования окиси углерода СО значительно выше, чем образования двуокиси СО2, и количество СО у поверхности горящего углерода будет преобладать.
Рисунок 1.7 – Зависимость скорости реакции от температуры и энергии активации
Энергия активации является главным фактором, определяющим скорость реакции: чем меньше энергия активации, тем выше скорость.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 803; Нарушение авторских прав?; Мы поможем в написании вашей работы!