
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое строение и физико-химические свойства
|
|
|
|
Фосген и дифосген
 С1
С1
 Фосген. О=С дихлорангидрид угольной кислоты.
Фосген. О=С дихлорангидрид угольной кислоты.
С1
Впервые получен английским химиком Д.Дэви в 1812 году при взаимодействии хлора с окисью углерода на прямом солнечном свету: СО+С1=СОС1г. Метод получения этого вещества нашел отражение в его названии: «фос» по-гречески - свет, а «гене» - рождаю, т.е. светорожденный. Фосген - бесцветный газ с характерным запахом, напоминающим запах прелого сена или гниющих фруктов. Он в 3]/2 раза тяжелее воздуха, легко сжижается в бесцветную летучую жидкость плотностью 1,42 г/см (при О°), темпера тура кипения +8,2'. При сильном охлаждении фосген застывает в белую кристаллическую массу, плавящуюся при температуре-118". Технический жидкий фосген имеет желтую или желтовато-коричневую окраску. В воде фосген растворяется плохо, но хорошо растворяется в органических растворителях. Так, в одном объеме керосина можно растворить 263 объема фосгена. Фосген очень реакционноспособен, легко гидролизуется водой с образованием безвредных продуктов:
СОС12.+ Н2О = 2НС1 + СО2
Легко реагирует со всеми щелочами, аммиаком, уротропином, анилином, при взаимодействии с аммиаком образует мочевину:
СОС1 г + 4NH3 - > С0(NH2)2 + 2NH4C1. мочевина
Реакция с анилином служит для открытия фосгена: образуется нерастворимая в воде дифенилмочевнна. Реакция фосгена с уротропином:
СОСЬ + (CH2)6N4 == (CH2)6N4 -CO -C12
использовалась во время первой мировой войны для защиты от этого отравляющего вещества во влажных противигазах.
С1 С1
 |  |
 Дифосген. О=С-О-С—С1 трихлрорметиловый эфир хлоругольной кислоты
Дифосген. О=С-О-С—С1 трихлрорметиловый эфир хлоругольной кислоты
С1
название получил от фосгена, имеющего тот же состав, но вдвое меньший молекулярный вес. Дифосген - бесцветная, подвижная, маслянистая жидкость с запахом прелого сена или гниющих фруктов. По характеру своих реакций напоминает фосген. В присутствии влаги подвергается гидролизу:
С1СООСС1з + Н20 - > 2С02+ 4НС1.
При действии аммиака дифосген подобно фосгену образует мочевину
С1СООСС1 з + 4NH3 - 2CO(NH2)2 + 4HC1.
Под действием сильных щелочей быстро разрушается:
С1СООСС1з + 8NaOH -> 2 Na2CO3 + 4 NaCl+ 4H2O.
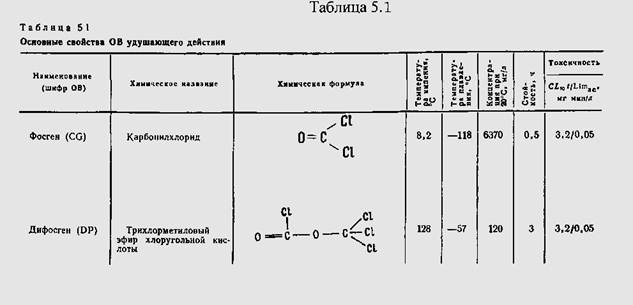
Сводные данные о физико-химических свойствах фосгена и дифосгена приведены в табл.24.
Поражающие свойства фосгена и дифосгена. Несмотря на то что удушающие отравляющие вещества значительно уступают по токсичности фосфорорганическим отравляющим веществам, они тем не менее достаточно ядовиты, чтобы вызвать в малых концентрациях тяжелое или смертельное поражение незащищенного человека. До появления ФОБ фосген и дифосген считались наиболее токсичными среди отравляющих веществ, которые применялись для создания в воздухе поражающих концентраций; они уступали только хлорциану и синильной кислоте. Фосген и дифосген близки по токсичности. Средняя смертельная концентрация этих веществ (LCso) при 10-минутном воздействии 0,5 мг/л. Смертельная концентрация дифосгена при 15- минутной экспозиции 0,5 - 0,7 мг/л. При концентрациях 40 - 50 мг/л фосген и дифосген вызывают мгновенную смерть. Минимальная действующая концентрация фосгена 0,005 мг/л; средняя выводящая из строя токсическая доза LC50 составляет 1,6 мг • мин/л.
Фосген и дифосген поражают организм только через органы дыхания. Фосген является типичным представителем нестойких ОВ, дифосген иногда называют полу стойким отравляющим веществом.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1419; Нарушение авторских прав?; Мы поможем в написании вашей работы!