
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расход воздуха при горении
|
|
|
|
Важной характеристикой процесса горения различных веществ является расход воздуха, обеспечивающий горение.
Минимальное количество воздуха, необходимое для полного сгорания единицы массы (кг) или объема (м3) горючего вещества, называется теоретически необходимым и обозначается  . Величину
. Величину  находят по уравнению реакции горения.
находят по уравнению реакции горения.
Пусть на m кмоль горючего вещества приходится n кмоль кослорода и  кмоль азота. Обозначив массу (в кг) горючего вещества, численно равную молекулярной массе через М, составляют пропорцию:
кмоль азота. Обозначив массу (в кг) горючего вещества, численно равную молекулярной массе через М, составляют пропорцию:
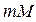
 -
- 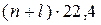

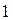
 -
- 

где 22,4 – объём 1 кмоль газов (при  и 101,3 кПа)
и 101,3 кПа)
Теоретически необходимый объём воздуха для сгорания 1 кг вещества равен (из пропорции)
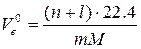 (2.14)
(2.14)
Если объем воздуха необходимо привести к иным условиям, пользуются соотношением
 , (2.15)
, (2.15)
где Т – заданная температура, К;
Р – заданное давление, кПа.
Теоретически необходимый объем воздуха для сгорания 1 м3 горючих газов находится по соотношению
 (2.16)
(2.16)
Пример. Определить расход воздуха при сгорании 1кг клетчатки, 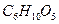 , являющейся основой древесины, при температуре воздуха
, являющейся основой древесины, при температуре воздуха  и давлении 100кПа.
и давлении 100кПа.
Решение. 1. Составляем уравнение реакции горения клетчатки, принимая в (1.34) значения индексов а=6, b=10, с=5, d=0
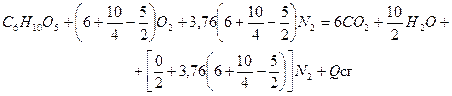
На горение 1 кмоль клетчатки требуется  кмоль воздуха.
кмоль воздуха.
2 Необходимый объем воздуха для сгорания 1 кг клетчатки при нормальных условиях определяется по соотношению (2.14)
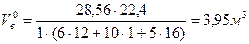
3. Расход воздуха при заданных условиях горения определяется по соотношению (2.15)
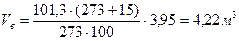 .
.
В практике пожарного дела элементный состав горючего вещества часто задают в весовых (массовых) процентах. Пусть в состав горючего вещества входят C, H, O, S, зола (А), влага (W). Расход воздуха  при горении такого вещества можно определить следующим образом. Составляют уравнения реакций горения углерода, водорода и серы и находят массовые соотношения реагирующих веществ [6]:
при горении такого вещества можно определить следующим образом. Составляют уравнения реакций горения углерода, водорода и серы и находят массовые соотношения реагирующих веществ [6]:

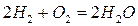


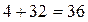
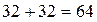
Если для сгорания 12 кг углерода требуется 32 кг кислорода, то для сгорания 0,01 кг углерода, то есть 1% (от массы 1 кг углерода) потребуется кислорода  кг, для водорода соответственно потребуется
кг, для водорода соответственно потребуется  кг и для серы
кг и для серы  кг кислорода.
кг кислорода.
Для сгорания 1 кг горючего вещества потребуется кислорода
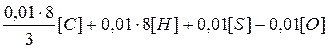 , кг,
, кг,
где 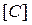 ,
, 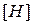 ,
,  ,
, 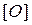 - содержание углерода, водорода, серы и кислорода в горючем веществе, % (масс.).
- содержание углерода, водорода, серы и кислорода в горючем веществе, % (масс.).
Массу воздуха  , кг, необходимую для сжигания 1 кг вещества, можно найти по соотношению
, кг, необходимую для сжигания 1 кг вещества, можно найти по соотношению
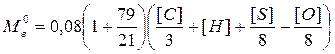 (2.17)
(2.17)
Расход воздуха 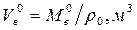 , где
, где 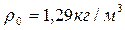 , находится по соотношению
, находится по соотношению
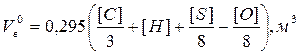 (2.18)
(2.18)
Пример. Определить расход воздуха при сгорании 1 кг торфа, в состав которого входят углерод (40%), водород (4%), кислород (13%), азот (20%), влага (13%), зола (10%).
Решение. 1. Азот, зола и влага горючего при определении расхода воздуха не учитываются, так как они не принимают участия в реакции горения.
2. Расход воздуха при сгорании 1 кг торфа вычисляем по соотношению (2.18)
 .
.
Расход воздуха для полного сгорания некоторых широко известных веществ приведён в табл. 9.
Таблица 9
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1972; Нарушение авторских прав?; Мы поможем в написании вашей работы!