
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Продукты сгорания при горении каменного угля
|
|
|
|
| Элементный состав горючего вещества | Продукты сгорания, 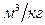
| |||
| СО2 | Н2О | SO2 | N2 | |
| Углерод | 1,86·0,758=1,4 | - | - | 7·0,758=5,306 |
| Водород | - | 11,2·0,038=0,425 | - | 21·0,038=0,798 |
| Сера | - | - | 0,7·0,25=0,017 | 2,63·0,025=0,658 |
| Азот | - | - | - | 0,8·0,011=0,009 |
| Влага | - | 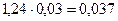
| - | - |
| Итого: | 1,4 | 0,462 | 0,017 | 6,771-0,074= =6,697 |
Примечание: Из общего объёма N2 вычитается объём N2, приходящийся на кислород в составе каменного угля 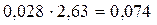 м3.
м3.
Объём всех продуктов составит: 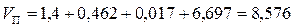 м3.
м3.
Для определения температуры горения нужно также знать теплоёмкости 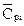 или теплосодержание продуктов сгорания при различных температурах t. Теплосодержание газообразных продуктов сгорания приведено в табл.11.
или теплосодержание продуктов сгорания при различных температурах t. Теплосодержание газообразных продуктов сгорания приведено в табл.11.
Таблица 11
Теплосодержание газов при постоянном давлении
| Температура оС | Теплосодержание, 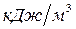
| ||||
| СО2 | Н2О | SO2 | O2 | N2 | |
| 170,1 357,7 772,6 | 150,6 304,7 626,8 969,5 | 181,4 337,9 824,6 | 131,8 267,2 | 130,1 260,9 528,7 807,8 |
Пример. Определить температуру горения керосина, состоящего из 86% углерода, 13% водорода и 0,3% серы. Теплота сгорания керосина 43347 кДж/кг.
Решение. 1.Используя реакции горения углерода, водорода, серы (2.21), находим объём продуктов сгорания
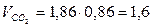 м3
м3
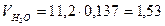 м3
м3
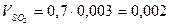 м3
м3
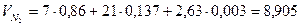 м3
м3
Итого: VП =1,6+1,53+0,002+8,905=12,04м3
Теплосодержание 1м3 продуктов сгорания
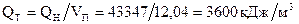 .
.
2.В продуктах сгорания больше всего азота. Следовательно, на его теплосоединение целесообразно ориентироваться при подборе значения tг. Поскольку теплосодержание СО2 и Н2О выше, чем теплосодержание N2, в качестве первого приближения примем tг=2200оС. Теплосодержание продуктов сгорания при этой температуре составляет:
СО2 - 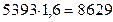
Н2О - 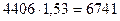
SO2 - 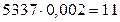
N2 - 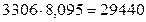
Итого: 44821 кДж/кг
3.Так как 44821 кДж/кг 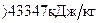 , в качестве второго приближения принимаем значение tг=2000 оС. Находим:
, в качестве второго приближения принимаем значение tг=2000 оС. Находим:
СО2 - 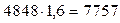
Н2О - 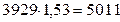
SO2 - 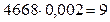
N2 - 2980·8,095=26537
Итого: 39314 кДж/кг
4.Поскольку 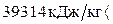
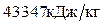
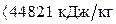 , значение tг находим интерполяцией
, значение tг находим интерполяцией
tг= 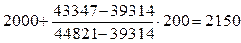 оС.
оС.
Самостоятельный интерес представляет использование средних значений теплоемкости продуктов сгорания 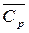 для определения температуры горения.
для определения температуры горения.
Пусть, например, требуется оценить температуру горения пропано- воздушной смеси стехиометрического состава.
Выпишем реакцию горения такой смеси, используя уравнение (1.39)
C3H8 + 5O2+ 5*3,76 N2 = 3CO2 +2H2O + 5*3,76N2 + Q сг
Для нахождения температуры горения смеси воспользуемся соотношением (2.19), представив его в виде
Q н = Q т = 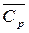 * t г, (2.22)
* t г, (2.22)
где Q н, Q т – низшая теплота сгорания и теплосодержание соответственно; 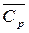 = n i
= n i 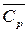 i - средняя теплоемкость продуктов сгорания при изменении температуры от начальной t0 до температуры горения t г; n i – число молей i– го продукта сгорания;
i - средняя теплоемкость продуктов сгорания при изменении температуры от начальной t0 до температуры горения t г; n i – число молей i– го продукта сгорания; 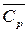 i – средняя теплоемкость i – го продукта сгорания.
i – средняя теплоемкость i – го продукта сгорания.
Для определения величины 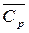 воспользуемся соотношением (1.26), согласно которому Cp = C v + R, где R – универсальная газовая постоянная.
воспользуемся соотношением (1.26), согласно которому Cp = C v + R, где R – универсальная газовая постоянная.
Принято величину средней теплоемкости 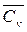 представлять в виде
представлять в виде
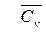 = a+bt+ct2. В приближенных расчетах ограничиваются зависимостью С v = a + bt.
= a+bt+ct2. В приближенных расчетах ограничиваются зависимостью С v = a + bt.
Одним из первых, определивших значение 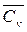 для ряда газов (N2,O2,H2,CO, CO2,H2O (пар)), были Mallard и Le Chatelier [11].
для ряда газов (N2,O2,H2,CO, CO2,H2O (пар)), были Mallard и Le Chatelier [11].
Позднее предложены следующие зависимости [12]:
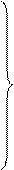
Двухатомные газы 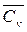 = 4,8 + 4,5 *10-4 * t кал/моль * град
= 4,8 + 4,5 *10-4 * t кал/моль * град
Пары воды 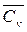 = 4,0 + 21,5 * 10-4 * t кал/моль * град.
= 4,0 + 21,5 * 10-4 * t кал/моль * град.
Углекислый газ 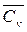 = 9.0 + 5.8 * 10-4 * t кал/моль * град (2.23)
= 9.0 + 5.8 * 10-4 * t кал/моль * град (2.23)
Четырехатомные газы 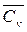 = 10 + 4.5 * 10-4 * t кал/моль * град
= 10 + 4.5 * 10-4 * t кал/моль * град
Пятиатомные газы 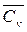 = 12 + 4.5 *10-4 * t кал/моль * град
= 12 + 4.5 *10-4 * t кал/моль * град
Ниже для определения значений 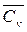 используется апроксимация данных [13]:
используется апроксимация данных [13]:
 N2
N2 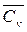 = 4.96 + 0,0006 t кал/моль.град при 0< t < 3000
= 4.96 + 0,0006 t кал/моль.град при 0< t < 3000
H2O (пар) 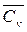 = 5,96 + 0,00135 t кал/моль.град при 0< t < 3000 (2.24)
= 5,96 + 0,00135 t кал/моль.град при 0< t < 3000 (2.24)
CO2 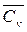 = 9,0 + 0,00093 t кал/моль.град при 0< t < 3000
= 9,0 + 0,00093 t кал/моль.град при 0< t < 3000
Найдем теплоемкости 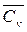 продуктов сгорания рассматриваемой реакции горения:
продуктов сгорания рассматриваемой реакции горения:
18,8 N2 18,8(4,96 + 0,0006t) = 93,25 + 0,01128 t
4Н2О 4 (5,96 + 0,00135t) = 23,84 + 0,0054 t
3СO2 3 (9,0 + 0,00093t) = 27 + 0.00279 t
Всех продуктов: 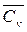 = 144.09+ 0.01947 t
= 144.09+ 0.01947 t
Число молей продуктов сгорания N =Σ ni = 3+4+18,8=25,8. Следовательно, C p = 144,09 + 0,01947t + 25,8 * 1,99 = 195,43 + 0,01947 t.
Теплота сгорания пропана Q сг = Q н = 46,4 МДж/кг = 2042 кДж/моль =
= 487* 103 кал/моль (см.табл.32). Так как Q н = C p·· t г, имеет место уравнение
0,01947 t 2г + 195,43 t г – 487 * 103 = 0
Решая уравнение, получаем:
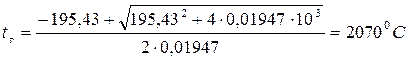
Примечание: расчет по способу, изложенному в предыдущем примере с использованием данных табл.11, дает значение температуры горения рассматриваемой смеси t г = 21000 С.
В табл.12 приведены для сравнения действительные температуры горения керосина и горючих газов в атмосфере воздуха. Приведены также данные по температуре горения некоторых других веществ и материалов.
Таблица 12
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 4672; Нарушение авторских прав?; Мы поможем в написании вашей работы!