
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Биологическое значение. Потенциалы, возникающие в живых организмах – диффузионные, мембранные, межфазовые, окислительно-восстановительные – являются по своей химической природе
|
|
|
|
Потенциалы, возникающие в живых организмах – диффузионные, мембранные, межфазовые, окислительно-восстановительные – являются по своей химической природе аналогами электродных потенциалов. В тканях организма, даже внутри одной клетки, имеются мембранные и межфазовые потенциалы, обусловленные морфологической и химической неоднородностью внутреннего содержания клеток. При работе сердца, сокращениях мышц и т.д. возникают так называемые токи действия, являющиеся результатом различной проницаемости клеточных мембран для различных ионов. Вследствие этого концентрация ионов по обеим сторонам мембраны неодинакова (возникает мембранный потенциала). В момент возбуждения (сокращения мышц и т.д.) избирательность проницаемости мембран утрачивается и сквозь них устремляется поток ионов – возникает электрический ток.
Существует теория возникновения биоэлектрических потенциалов. Согласно ей, в покое электролиты внутри клетки избирательно связываются белками, в результате возникает межфазовая разность потенциалов между протоплазмой и водным раствором электролита (потенциал покоя). При возбуждении или повреждении клетки фазовые свойства белков протоплазмы изменяются, распределение ионов становится другим и соответственно меняется потенциал (возникает потенциал действия или повреждения). Величина потенциала покоя для нервных волокон у амфибий составляет 70 мВ, для мышечных волокон сердца теплокровных животных – 95 мВ.
Окислительно-восстановительные (red/ox - редокс) потенциалы имеют большое значение в физиологии растений и животных. К числу редокс-систем животных относят такие системы в крови и тканях как гем-гематин и цитохромы, в которых содержится двух- и трехвалентное железо; аскорбиновая кислота (витамин С), находящаяся в окисленной и восстановленной формах; система глютатиона, цистин-цистеин и др.
Важнейший процесс биологического окисления, а именно, перенос электронов и протонов с окисляемого субстрата на кислород, осуществляемый в тканях при помощи строго определенного ряда промежуточных ферментов-переносчиков, также представляет собой цепь окислительно-восстановительных процессов, каждое звено этой цепи соответствует той или иной редокс-системе, характеризующейся определенным редокс-потенциалом.
Окислительно-восстановительные реакции играют важную роль в процессах почвообразования, на что впервые указал В.Р. Вильямс. Нормальный рост и развитие растений возможны только при определенном окислительно-восстановительном состоянии почвы.
Большая величина редокс-потенциала почвы указывает на то, что в почвенном растворе содержатся в значительном количестве вещества, находящиеся в окисленной форме. В качестве окислителей в почвенном растворе выступает главным образом кислород и некоторые ионы, способные присоединять электроны – анион азотной кислоты NO3- трехвалентные катионы железа, марганца и др.
Малое значение редокс-потенциала почвы обусловлено наличием в ней значительных количеств восстановителей, к которым относятся, прежде всего, легко окисляющиеся органические вещества, а также двухвалентные катионы железа и марганца.
Преобладание в почве окислителей приводит к тому, что ионы Fe ++ и Mn++ окисляются в трехвалентные ионы, которые выпадают из почвенного раствора в виде нерастворимых соединений. В результате этого нарушается нормальное питание растений, т.к. они не получают необходимого количества железа и марганца.
При избытке в почве восстановителей железо и марганец находятся в растворе в виде двухвалентных ионов в таких концентрация, при которых они оказывают вредное действие на растительные организмы.
Как показали многочисленные исследования, для нормального развития растений необходимо, чтобы редокс-потенциал почвы находился в пределах 0,2-0,7 В.
Вопросы для самоконтроля:
1.Возникновение скачка потенциала на границе раздела металл-раствор.
2.Уравнение электродного потенциала (Нернста).
3.Что такое электрод? Примеры.
4.Электроды первого и второго рода, их назначение.
5.Электроды сравнения. Примеры.
6.Окислительно-восстановительные электроды и цепи. Уравнение Нернста-Петерса.
7.Гальванические элементы (цепи). Концентрационные цепи. Примеры.
8.Диффузионный потенциал и меры его устранения.
Экспериментальная часть:
Работу проводят на ионометре (потенциометре). Перед началом работы прибор включают в сеть и дают ему прогреться в течение 5 минут. Работают при нажатых клавишах “±” и “mV” на левом клавишном переключателе.
Прибор имеет две шкалы, которые переключаются клавишами правого ряда. Нижняя шкала включается клавишей “-1 - 19”. Она имеет деления от -1 до 19; эта шкала грубая и служит для выбора одного из более узких диапазонов измерения (“-1 - 4”, “4 - 9”, “9 - 14”, “14 - 19”). Точное измерение проводят по верхней шкале, предварительно нажав кнопку выбранного диапазона. Например, выбран диапазон “-1 - 4”, следовательно, первое большое деление на верхней шкале соответствует “-1”, а затем идут соответственно 0; 1; 2; 3; 4. Если выбран диапазон измерений “9 - 14”, нажимаем соответствующую кнопку диапазона, при этом первое деление соответствует “9”, а последующие 10, 11, 12, 13, 14.
Шкала прибора откалибрована в милливольтах (mV), следовательно, чтобы снятое с прибора показание выразить в вольтах, необходимо
PX×100/1000 = pX/10,
где pX - показание прибора.
Задание 1. Измерение ЭДС медно-цинкового гальванического элемента (элемента Даниеля – Якоби).
Схематическая запись элемента:
Сu|CuSO4| KCl | ZnSO4|Zn
E = eCu - eZn
В проточную электродную ячейку медного полуэлемента наливают до половины её объема 1М раствор CuSO4 (fa = 0,041) и опускают в раствор медную пластинку. В проточную электродную ячейку цинкового полуэлемента наливают столько же 1М раствора ZnSO4 (fa = 0,041) и погружают в него цинковую пластинку. Собранные электроды закрепляют в штативе. На столик штатива устанавливают стаканчик с насыщенным раствором KCl и приступают к измерению ЭДС. Для этого необходимо присоединить зажимы к электродам и снять показания с прибора, как описано выше. Найденную опытным путем ЭДС (Еоп) записывают в таблицу3. Полученные результаты проверяют у преподавателя и приступают к выполнению второго задания. Медный и цинковый электроды оставляют для выполнения последующей работы.
Таблица 3
Результаты определения ЭДС гальванических элементов и
потенциалов отдельных электродов
| Гальванические цепи | Еоп, В | Етеор, В | eоп, В |
| Cu|CuSO4(1 M)| KCl |ZnSO4(1 M)|Zn | |||
| Ag|AgCl, KCl| KCl | ZnSO4 (1 M)|Zn | - | eZn = | |
| Cu|CuSO4 (1 M)| KCl | KCl, AgCl|Ag | - | eCu = | |
| Cu|CuSO4 (1 M)| KCl | CuSO4 (0,01М)|Cu | |||
Pt| 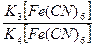 | KCl |KCl,AgCl|Ag | KCl |KCl,AgCl|Ag
| - | eов = | |
| Pt| почва| KCl | KCl, AgCl|Ag | - | eов = |
Задание 2. Измерение электродвижущей силы хлорсеребряно-цинкового гальванического элемента и вычисление потенциала
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 628; Нарушение авторских прав?; Мы поможем в написании вашей работы!