
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенциометрический метод определения рН
|
|
|
|
В настоящее время наиболее распространен потенциометрический метод определения рН, поскольку он является наиболее точным и быстрым. Метод основан на измерении ЭДС гальванической цепи, составленной из электрода, обладающего водородной функцией, и электрода сравнения. Существует ряд электродов, обладающих водородной функцией (водородный, хингидронный, стеклянный), но в настоящее время в лабораторной практике широко применяется стеклянный электрод с водородной функцией, т.к. он обладает рядом преимуществ. Например, одним из преимуществ стеклянного электрода является то, что он позволяет определять рН раствора любого химического соединения в достаточно широком диапазоне значений.
Схематически стеклянный электрод, обладающий водородной функцией, записывается следующим образом:
Ag | AgCl, 0,1н HCl | 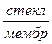 |
| 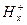 .
.
 Для измерения рН раствора составляют цепь из стеклянного и хлорсеребряного электродов. Хлорсеребряный электрод является электродом сравнения. Таким образом, стеклянно-хлорсеребряная цепь записывается так:
Для измерения рН раствора составляют цепь из стеклянного и хлорсеребряного электродов. Хлорсеребряный электрод является электродом сравнения. Таким образом, стеклянно-хлорсеребряная цепь записывается так:
Ag | AgCl, 0,1н НСl | 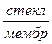 |
| 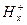
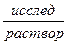 |KClнасыщ, AgCl| Ag.
|KClнасыщ, AgCl| Ag.
Величина потенциала стеклянного электрода (eст) связана с концентрацией Н+- ионов исследуемого раствора уравнением Нернста:
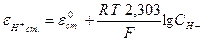 или
или
eН+ст. = e°Н+ст. + 0,0579 lgаН+
где: e0ст – потенциал асимметрии стеклянного электрода, величина переменная (в отличие от металлов) и поэтому требующая корректировки по буферным растворам.
Расчет рН растворов при использовании стеклянно-хлорсеребряной цепи потенциометрическим методом заключается в следующем. ЭДС любой гальванической цепи равна разности электродных потенциалов:
Е = eН+ст. - eхл.
подставим в данное уравнение значение электродного потенциала стеклянного электрода:
Е = e°Н+ст. + 0.0579 lgаН+ - eхл.
решим данное уравнение относительно рН:
-0.0579 lgаН+ = e°Н+ст. - eхл. – Е
а т.к. -lgаН+ = рН, то
рН = e°Н+ст. - eхл. – Е / 0,0579
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 381; Нарушение авторских прав?; Мы поможем в написании вашей работы!