
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрическая проводимость и ее использование для анализа растворов электролитов
|
|
|
|
Результаты определения буферной емкости номерного раствора
| Исследуемый раствор | Объем раствора, мл | рН исследуемого раствора | Объем и концентрация прибавленного раствора | рН раствора после прибавления реактива | DрН |
| .. |
Б = …….
Таблица 9
Результаты измерения рН и вычисления СН+ растворов
| N п/п | Исследуемый раствор | рН | СН+, М |
| Дистиллированная вода | |||
| Почвенная вытяжка водная |
По найденным значениям рН вычислить активность ионов водорода в растворе.
Пример: рН = 2,34
- lg aH+ = 2,34 lg aH+ = -2,34
lg aH+ = `3,66 aH+ = 4,57×10-3 М.
Результаты записать в таблицу 9.
По окончании работы с прибором электроды ополоснуть дистиллированной водой, на электрод сравнения надеть колпачок, стеклянный – погрузить в стаканчик с дистиллированной водой.
Одним из многообразных физических свойств растворов электролитов является электрическая проводимость, т.е. их способность проводить электрический ток под действием внешнего электрического поля.
Эта способность электролитов объясняется наличием ионов, несущих положительные и отрицательные заряды, которые в отсутствии внешнего электрического поля движутся беспорядочно, все направления перемещения ионов являются равновероятными. При наложении внешнего электрического поля движение ионов становится упорядоченным. Катионы двигаются по направлению к катоду, а анионы в противоположном направлении - к аноду.
Так как перенос электричества в растворах осуществляется за счет движения ионов, то количество электричества, переносимое через раствор, зависит от ряда факторов: от природы вещества (сильный или слабый электролит); концентрации ионов; температуры и других параметров.
Мерой электрической проводимости L растворов электролитов является количество электричества, выраженное в кулонах, которое проходит через раствор за единицу времени. Сила тока, возникающего при движении ионов в растворе электролита под влиянием внешнего электрического поля, будет определяться уравнением:
I = L × E
где I - сила тока, L - электрическая проводимость раствора, Е - напряженность внешнего электрического поля.
С другой стороны, согласно закону Ома, сила тока равна:

где R - сопротивление раствора.
При сравнении этих двух уравнений получим:

Таким образом, электрическую проводимость раствора электролита можно характеризовать как величину, обратную сопротивлению.
Сопротивление электролита зависит от длины проводника ( ), площади поперечного сечения (S) и удельного сопротивления (r):
), площади поперечного сечения (S) и удельного сопротивления (r):

Если мы подставим значение R в уравнение электрической проводимости, то получим:
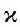
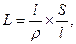
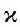 где: величина, обратная удельному сопротивлению 1/r =, называется удельной электрической проводимостью. Обозначается она греческой буквой
где: величина, обратная удельному сопротивлению 1/r =, называется удельной электрической проводимостью. Обозначается она греческой буквой
(«каппа»). В результате получим уравнение:
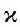 L = ×
L = × 
 При условии, что S = 1 м2 и l = 1 м, электрическая проводимость раствора электролита будет равна удельной электрической проводимости:
При условии, что S = 1 м2 и l = 1 м, электрическая проводимость раствора электролита будет равна удельной электрической проводимости:
L =
Удельная электрическая проводимость - это электрическая проводимость раствора электролита, помещенного между электродами площадью поперечного сечения 1 м2, отстоящими друг от друга на 1 м. То есть удельной электрической проводимостью называется электрическая проводимость 1 м3 данного электролита. В системе СИ единицей электрической проводимости является Cименс (См), следовательно, удельную электрическую проводимость растворов выражают в См / м.
 Так как переносчиками электрических зарядов в растворах являются ионы, то электрическая проводимость раствора будет тем больше, чем больше концентрация ионов, чем быстрее они движутся в электрическом поле и чем больше их валентность. С увеличением концентрации удельная электрическая проводимость увеличивается, достигает максимального значения, а при очень больших концентрациях (порядка 10 моль/л и выше)
Так как переносчиками электрических зарядов в растворах являются ионы, то электрическая проводимость раствора будет тем больше, чем больше концентрация ионов, чем быстрее они движутся в электрическом поле и чем больше их валентность. С увеличением концентрации удельная электрическая проводимость увеличивается, достигает максимального значения, а при очень больших концентрациях (порядка 10 моль/л и выше)
начинает уменьшаться (рис.2).
 Такая зависимость четко выражена для сильных электролитов и в меньшей степени для слабых электролитов. Наличие максимумов на кривых объясняется тем, что в разбавленных растворах сильных электролитов скорость движения ионов почти не зависит от концентрации и растет прямо пропорционально числу ионов, которое увеличивается с концентрацией. При достижении определенной концентрации в растворах сильных электролитов скорость движения ионов уменьшается из-за появления ионных атмосфер, вследствие чего уменьшается скорость движения иона, в результате чего удельная электрическая проводимость также уменьшается.
Такая зависимость четко выражена для сильных электролитов и в меньшей степени для слабых электролитов. Наличие максимумов на кривых объясняется тем, что в разбавленных растворах сильных электролитов скорость движения ионов почти не зависит от концентрации и растет прямо пропорционально числу ионов, которое увеличивается с концентрацией. При достижении определенной концентрации в растворах сильных электролитов скорость движения ионов уменьшается из-за появления ионных атмосфер, вследствие чего уменьшается скорость движения иона, в результате чего удельная электрическая проводимость также уменьшается.
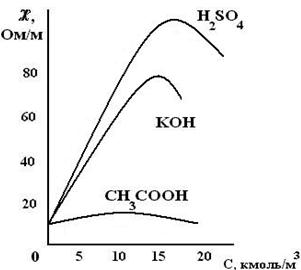 Для растворов слабых электролитов уменьшение удельной электрической проводимости с ростом концентрации объясняется уменьшением степени диссоциации. В результате количество образовавшихся ионов в растворе слабого электролита будет возрастать в меньшей степени, чем аналитическая концентрация раствора.
Для растворов слабых электролитов уменьшение удельной электрической проводимости с ростом концентрации объясняется уменьшением степени диссоциации. В результате количество образовавшихся ионов в растворе слабого электролита будет возрастать в меньшей степени, чем аналитическая концентрация раствора.
 |
Рис.2. Зависимость растворов сильных и слабых растворов электролитов от С.
Поскольку перенос электричества в растворах осуществляется за счет движения ионов, следовательно, его количество зависит от скорости движения ионов, которая обратно пропорциональна их ионному радиусу.
Так как ионы в водной среде гидратируются, то необходимо учитывать гидратированный «эффективный» радиус иона, а не кристаллохимический.
Электропроводность растворов щелочных металлов:
кристаллохимический радиус иона
 Li+ Na+ K+ Rb+ Cs+
Li+ Na+ K+ Rb+ Cs+
 радиус гидратированного иона
радиус гидратированного иона
Абсолютная скорость движения иона (U) – путь в метрах, пройденный ионом за 1 секунду при напряженности электрического поля в 1 Вольт. Размерность абсолютной скорости м2×В-1×с-1. Эти скорости в обычных условиях очень малы и составляют величины порядка 10-7… 10-8 м2×В-1×с-1 Незначительная скорость ионов объясняется их высокой гидратацией и сопротивлением среды. Обращают на себя внимание большие значения скоростей ионов водорода (33,6×10-8) и гидроксила (18,7×10-8) в воде по сравнению с другими ионами, что объясняется эстафетным перемещением этих ионов.
Протоны проходят не весь путь до катода, а только расстояние между молекулами воды, т.е. как бы передаются по эстафете от одной молекулы воды до другой. Средняя продолжительность жизни иона гидроксония (Н3О+) составляет 10-11сек. Большая скорость движения ОН- - ионов объясняется тем же механизмом, однако при этом протон передается от молекулы воды к гидроксил-ионам. В результате процесс выглядит как перемещение ОН- - ионов к аноду.
Для оценки количества электричества, переносимого через раствор катионами и анионами в отдельности, используется понятие электролитической подвижности ионов - катиона ( к) и аниона (
к) и аниона ( а):
а):
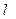 к = Uк F
к = Uк F
 а = Ua F,
а = Ua F,
где F – число Фарадея = 96500 кул.
Влияние заряда иона на удельную электрическую проводимость состоит в том, что, чем выше заряд иона, тем больше электричества он переносит с одного электрода на другой. В таблице 10 даются  к и
к и  а некоторых ионов.
а некоторых ионов.
Таблица 10
Подвижности ионов (  ∞) при бесконечном разведении (катионы)
∞) при бесконечном разведении (катионы)
| ионы | температура, ºС | ионы | температура, ºС | ||||||
| Н+(Н2О) | 225,0 | 315,0 | 349,7 | 637,0 | ⅓Se+++ | - | - | 64,7 | - |
| Li+ | 19,1 | 33,4 | 38,7 | 120,0 | ⅓Ce+++ | - | - | 67,0 | - |
| Nа+ | 25,9 | 43,5 | 50,1 | 150,0 | ⅓Cr+++ | - | - | 67,0 | - |
| К+ | 40,3 | 64,6 | 73,5 | 200,0 | ½Mn++ | 27,0 | 44,0 | 53,5 | - |
| Rb+ | - | 67,5 | 77,5 | - | ½Fe++ | 28,0 | 44,0 | 53,5 | - |
| Cs+ | 44,0 | 68,0 | 76,8 | 200,0 | ⅓Fe+++ | - | - | 68,0 | - |
| NH4+ | 40,3 | 64,0 | 73,7 | 184,0 | ½Co++ | 28,0 | 45,0 | 54,0 | - |
| ½Ве++ | - | - | 45,0 | - | ½Ni++ | 28,0 | 45,0 | 54,0 | - |
| ½Mg++ | 28,5 | 45,0 | 53,1 | 170,0 | ½Cu++ | 20,0 | 45,0 | 56,0 | - |
| ½Ca++ | 30,8 | 51,0 | 59,5 | 187,0 | Ag+ | 33,0 | 54,0 | 61,9 | 180,0 |
| ½Sr++ | 31,0 | 51,0 | 59,5 | - | ½Zn++ | 28,0 | 45,0 | 53,5 | - |
| ½Ва++ | 33,6 | 55,0 | 63,7 | 200,0 | ½Cd++ | 28,0 | 45,0 | 54,0 | - |
| ½Ra++ | 33,0 | 56,6 | 66,8 | - | Tl+ | 43,0 | 66,0 | 74,9 | - |
| ⅓Al+++ | 29,0 | - | 63,0 | - | ½Rb++ | 38,0 | 60,0 | 70,0 | - |
Анионы
| ионы | температура, ºС | ионы | температура, ºС | ||||||
| OH- | 105,0 | 174,0 | 200,0 | 446,0 | ½SeO42- | - | 65,0 | 75,7 | - |
| F- | - | 46,6 | 55,4 | - | N3- | - | - | 69,5 | - |
| Cl- | 41,4 | 65,5 | 76,3 | 207,0 | NO2- | 44,0 | 59,0 | 72,0 | 189,0 |
| ClO2- | - | - | 52,0 | - | NO3- | 40,2 | 61,7 | 71,4 | - |
| ClO3- | 36,0 | 55,0 | 64,0 | 172,0 | NCO- | - | 54,8 | 64,6 | - |
| ClO4- | 37,3 | 59,1 | 68,0 | 179,0 | PO4H2- | - | 28,0 | 36,0 | - |
| Br- | 41,3 | 67,6 | 78,4 | - | ½PO4H2- | - | - | 57,0 | - |
| BrO3- | 31,0 | 49,0 | 56,0 | 155,0 | AsO4H2- | - | - | 34,0 | - |
| J- | 42,0 | 66,5 | 76,9 | - | CO3H- | - | - | 44,5 | - |
| JO3- | 21,0 | 33,9 | 41,0 | 127,0 | ½ CO32- | 36,0 | 60,5 | 72,0 | - |
| JO4- | - | 49,0 | 55,6 | - | CN- | - | - | 78,0 | - |
| SH- | 40,0 | 57,0 | 65,0 | - | ½CrO42- | 42,0 | 72,0 | 85,0 | - |
| SO3H- | 27,0 | - | 50,0 | - | MnO42- | 36,0 | 53,0 | 62,8 | - |
| ½ SO32- | - | - | 72,0 | - | HCOO- | - | 47,0 | - | - |
| ½ SO42- | 34,0 | 68,3 | 79,8 | 256,0 | CH3COO- | 20,0 | 34,0 | 41,0 | 130,0 |
| ½S2O82- | - | - | 86,0 | - | ½(C2O4)2- | 32,0 | 63,0 | - | - |
| SCN- | 41,7 | 56,6 | 66,5 | - |
С ростом температуры удельная электрическая проводимость растворов электролитов увеличивается в среднем на 2 % на каждый градус. Увеличение электрической проводимости с ростом температуры объясняется уменьшением вязкости воды, а также ростом кинетической энергии ионов, т.е. скорости их движения.
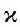 Так как удельная электрическая проводимость раствора электролита определяется количеством ионов между электродами с
Так как удельная электрическая проводимость раствора электролита определяется количеством ионов между электродами с  = 1 м и S = 1 м2 и скоростью этих ионов, то
= 1 м и S = 1 м2 и скоростью этих ионов, то
= Ск Uk F + Ca Ua F = Ci ( k +
k +  a),
a),
где Сi - ионная концентрация в 1 м3 раствора,  k и
k и  a – электролитические подвижности катиона и аниона.
a – электролитические подвижности катиона и аниона.
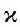 Концентрацию раствора (С) обычно выражают на 1 литр, тогда
Концентрацию раствора (С) обычно выражают на 1 литр, тогда
1000 = Сi ( k +
k +  a)
a)
Это уравнение называется основным уравнением электрической проводимости.
В слабых электролитах ионная концентрация (Ci) связана с аналитической концентрацией уравнением:
Ci = C a,
где a - степень электролитической диссоциации.
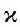 Тогда основное уравнение электрической проводимости для слабых электролитов будет иметь вид:
Тогда основное уравнение электрической проводимости для слабых электролитов будет иметь вид:
1000 = С a ( k +
k +  a)
a)
Степень электролитической диссоциации показывает, какая часть молекул электролита в растворе распалась на ионы:
a = 
Значение a измеряется в пределах от 0 до 1. Зависит от природы электролита, природы растворителя, температуры раствора и степени его разбавления. У большинства электролитов степень диссоциации по мере увеличения температуры увеличивается, а у некоторых (NH4OH, СН3СООН) достигает максимума, а затем уменьшается в связи с уменьшением диэлектрической постоянной растворителя, что благоприятствует образованию молекул из ионов.
Известно, чем больше диэлектрическая постоянная растворителя, тем сильнее выражен процесс диссоциации растворенного в нем вещества. С разбавлением раствора электролита вероятность взаимодействия ионов в растворе уменьшается, степень электролитической диссоциации увеличивается.
В сильных электролитах, где молекулы растворенного вещества полностью диссоциированы на ионы, ионная концентрация связана с аналитической концентрацией уравнением:
Ci = C fэ ,
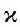 где fэ - коэффициент электрической проводимости, отражающий меру электростатического взаимодействия и гидратации ионов в растворе. По своему физическому смыслу fэ соответствует fa -коэффициенту активности. fэ увеличивается при разбавлении раствора и достигает 1 при максимальном разбавлении, когда силы взаимодействия между ионами приближаются к нулю. Для разбавленных (С£ 0.1) растворов электролитов fэ» 1. Поэтому при работе с биологическими растворами принимают fэ =1. Для сильных электролитов основное уравнение электропроводности имеет вид:
где fэ - коэффициент электрической проводимости, отражающий меру электростатического взаимодействия и гидратации ионов в растворе. По своему физическому смыслу fэ соответствует fa -коэффициенту активности. fэ увеличивается при разбавлении раствора и достигает 1 при максимальном разбавлении, когда силы взаимодействия между ионами приближаются к нулю. Для разбавленных (С£ 0.1) растворов электролитов fэ» 1. Поэтому при работе с биологическими растворами принимают fэ =1. Для сильных электролитов основное уравнение электропроводности имеет вид:
1000 = Сi fэ ( k +
k +  a)
a)
Поскольку удельная электрическая проводимость зависит от многих факторов, и на её основе нельзя сделать какие-либо выводы о влиянии на величину проводимости электролитов концентрации ионов, а также силы их взаимодействия, Ленц ввел понятие молярной или эквивалентной электрической проводимости.
Молярной электрической проводимостью λv называется электрическая проводимость столба раствора, содержащего 1 кмоль (г×экв) электролита, заключенного между электродами, расположенными на расстоянии 1 м друг от друга. Молярную электрическую проводимость обозначают греческой буквой l («лямбда»). Чтобы показать, к какому разбавлению раствора относится молярная электрическая проводимость, возле буквы l ставится индекс (v), обозначающий разбавление в литрах (V = 1/С), т.е. количество литров, содержащее 1 кмоль электролита, - lv.
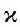 Формула, связывающая молярную электрическую проводимость с удельной имеет вид:
Формула, связывающая молярную электрическую проводимость с удельной имеет вид:
λv = 1000 V
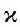 Отсюда:
Отсюда:
 λv = 1000
λv = 1000
С 
Размерность lv - См×м2/кмоль.
Последний множитель часто опускается и молярную электрическую проводимость выражают в См×м2, имея в виду 1 кмоль растворенного вещества.
Молярная электрическая проводимость у сильных и слабых электролитов возрастает с увеличением разбавления и достигает предельного значения, которое называется молярной электрической проводимостью при бесконечном разбавлении и обозначается l¥.
Молярная электрическая проводимость обусловлена при любом разбавлении одинаковым количеством электролита, а именно 1 кмоль. Ее возрастание с разбавлением для слабых электролитов объясняется тем, что при этом увеличивается степень диссоциации, т.е. увеличивается количество свободных ионов, переносящих электричество.
При достаточно большом разбавлении наступает полная диссоциация раствора (a = 1), в этот момент lv достигает максимального значения, равного l¥, и дальнейшее разбавление не изменяет данную величину, так как число ионов в растворе остается неизменным.

Рис.3. Влияние разбавления раствора на молярную электрическую проводимость.
Из рисунка 3 видно, что молярная электрическая проводимость растворов сильных электролитов быстро увеличивается и уже при умеренном разбавлении почти достигает предела. При разбавлении электролита увеличивается объем раствора, соответственно увеличивается расстояние между ионами. В определенный момент ионы достигают максимальной скорости движения. После этого с увеличением разбавления скорость движения остается неизменной, а молярная электрическая проводимость переходит в молярную электрическую проводимость при бесконечном разбавлении (l¥).
Растворы слабых электролитов ведут себя иначе. Их молярная электрическая проводимость до разбавления близка к нулю и затем медленно возрастает с увеличением разбавления, так как увеличивается степень диссоциации.
На основании изложенного выше:
l¥ = 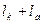
Следовательно, молярная электрическая проводимость электролита при бесконечном разбавлении равна сумме электролитических подвижностей катиона и аниона. В этом заключается закон Кольрауша (закон аддитивности) или закон независимого перемещения ионов.
Молярная электрическая проводимость также зависит от температуры и увеличивается на 2 - 2,5 % с увеличением температуры на градус.
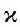
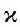 Используя основное уравнение электрической проводимости для слабых электролитов и закон Кольрауша, можно рассчитать степень электролитической диссоциации:
Используя основное уравнение электрической проводимости для слабых электролитов и закон Кольрауша, можно рассчитать степень электролитической диссоциации:
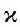 1000 = С a (
1000 = С a ( k +
k +  a)
a) 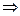 α = 1000 /С(
α = 1000 /С( k +
k +  a),
a),
где 1000 /С = λv, ( k +
k +  a) = l¥, тогда
a) = l¥, тогда
α = λv / l¥ (уравнение Аррениуса)
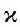 В случае сильных электролитов аналогично можно рассчитать коэффициент электрической проводимости:
В случае сильных электролитов аналогично можно рассчитать коэффициент электрической проводимости:
fэ = 1000 /С( k +
k +  a)= λv / l¥
a)= λv / l¥
Степень диссоциации зависит от концентрации и поэтому непригодна для количественной оценки силы электролита. Мерой силы слабого электролита является константа электролитической диссоциации, величина которой для данного электролита постоянна при любых концентрациях. Константа электролитической диссоциации определяется природой электролита и меняется лишь с изменением температуры. Чем константа электролита меньше, тем слабее данный электролит:
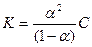
Приведенная формула является аналитическим выражением закона разбавления Оствальда.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 728; Нарушение авторских прав?; Мы поможем в написании вашей работы!