
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Биологическое значение. Живые организмы не являются исключением из законов природы
|
|
|
|
Живые организмы не являются исключением из законов природы. Любой организм, растительный и животный, находится в постоянном обмене
энергии и веществ с окружающей средой. Он поглощает разнообразные вещества в виде пищи, ассимилирует и трансформирует их в составные части своего тела, разрушает их в процессе диссимиляции и удаляет их в качестве отработанных продуктов во внешнюю среду. Многочисленными экспериментами была установлена подчиненность этих процессов закону сохранения материи и энергии.
Приведем для иллюстрации опыты Биддера и Шмидта над взрослой кошкой, находящейся в состоянии пищевого равновесия (цифры даны в г/1кг веса животного в сутки):
| поступления | общий вес | Н2О | С | Н | N | О | S | соли |
| мясо | 44.118 | 32.957 | 6.109 | 0.851 | 1.390 | 2.184 | 0.086 | 0.441 |
| вода | 27.207 | 27.207 | - | - | - | - | - | - |
| кислород | 18.632 | - | - | - | - | 18.632 | - | - |
| ИТОГО | 89.957 | 60.164 | 6.209 | 0.851 | 1.390 | 20.816 | 0.086 | 0.441 |
| выделения | ||||||||
| моча | 53.350 | 49.817 | 0.592 | 0.197 | 1.380 | 0.858 | 0.042 | 0.409 |
| кал | 0.910 | 0.718 | 0.075 | 0.010 | 0.002 | 0.031 | 0.044 | 0.032 |
| Н2СО3 | 20.322 | - | 5.542 | - | - | 14.870 | - | - |
| вода (через легкие и кожу) | 15.355 | 9.569 | - | 0.644 | - | 5.152 | - | - |
| потери азота | 0.008 | - | - | - | 0.008 | - | - | - |
| ИТОГО | 89.957 | 60.164 | 6.209 | 0.851 | 1.390 | 20.816 | 0.086 | 0.441 |
Таблица 13
Сравнение потребляемых и выделяемых веществ свидетельствует о глубоких превращениях пищи в организме. Эти превращения связаны с производством энергии, возникающей в процессе распада пищевых веществ и необходимой организму для производства работы (мышечное сокращение), для синтеза и ассимиляции, для выработки тепла.
Живые организмы также подчинены законам термохимии, в частности закону Гесса. Этот закон имеет огромное значение для физиологии и биохимии. Действительно, окисление пищевых продуктов в организме происходит через серию сложных реакций, однако, количество теплоты, выделяемое при этом, сравнимо с количеством теплоты, которое можно получить при непосредственном сжигании этих веществ в колориметрической бомбе (прибор для определения теплоты сгорания).
Закон Гесса дает основание использовать теплоты сгорания пищевых веществ для суждения об энергии окисления в организме. Экспериментальными исследованиями многих ученых были определены теплоты сгорания пищевых веществ в калориметрической бомбе и они оказались тождественны с калорийной ценностью при окислении в организме:
Таблица 14
| вещество | теплота сгорания в организме (ккал) | теплота сгорания в калориметре (ккал) |
| углеводы | 4,1 | 4,1 |
| жиры | 9,3 | 9,3 |
| белки | 4,1 | 5,7 |
Белки в организме окисляются не полностью. В качестве продукта неполного окисления белков выделяется мочевина, чем и обусловливается расхождение теплы сгорания в организме и калориметре.
Таким образом, приведенные данные неопровержимо свидетельствуют о том, что энергетические процессы в организме подчиняются закону сохранения энергии, как и любые химические реакции вне организма, идут по законам термохимии.
Вопросы для самоконтроля:
1. Что изучает термодинамика?
2. Что такое тепловой эффект химической реакции?
3. В каких единицах измеряются тепловые эффекты?
4. Как формулируется первое начало термодинамики? Его математическая запись.
5. Что представляет собой энтальпия и её физический смысл?
6. Тепловые эффекты при постоянном объеме и постоянном давлении?
7. Как формулируется второе начало термодинамики? Его математическая запись.
8. Изобарно-изотермический потенциал. Свободная энергия Гиббса и Гельмгольца.
9. Что изучает термохимия?
10. Закон Гесса, его математическая запись и следствия.
Экспериментальная часть:
При выполнении работы необходимо обращать внимание на знаки «+» или «-», которые характеризуют тепловые эффекты реакций. В термодинамике приняты следующие правила при обозначении обмена энергией между системой и внешней средой. В какой бы форме не происходил обмен энергией количество энергии, полученное системой, обозначается знаком «+». Количество энергии, отданное системой во внешнюю среду – знаком «-». В термохимии наоборот. Таким образом, в термодинамике и термохимии пользуются обратной системой знаков. Если система отдает энергию во внешнюю среду, в термохимии это обозначается плюсом (экзоэффект), а в термодинамике минусом. Если система приобретает энергию из внешней среды, в термохимии будет знак минус (эндоэффект), а в термодинамике знак плюс.
Приборы, при помощи которых определяют тепловые эффекты химических реакций, называются калориметрами. В этой работе для экспериментального определения теплового эффекта химической реакции используется калориметр с воздушной изотермической оболочкой. Подобные приборы обеспечивают точность определения тепловых эффектов до ± 2 % при изменении температуры системы на 0,5° и больше. Поскольку в калориметрах такой конструкции реакция происходит при постоянном (атмосферном) давлении, то измеряемый тепловой эффект будет представлять собой Qp. Калориметр состоит из толстостенного сосуда А емкостью 2 - 3 литра, в который на корковых пробках устанавливается стеклянный или пластмассовый стакан Б емкостью 500 -600 мл. Сосуд А закрывается стеклянной или пластмассовой крышкой с тремя отверстиями: для мешалки М, для термометра Т и для воронки В, через которую вносится реагент (рис. 4).
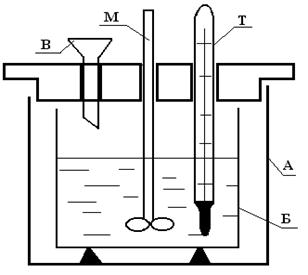
Рис.4. Калориметр.
А – внешний сосуд, Б – внутренний сосуд, в который заливается реагент, Т – термометр, М – мешалка, В – воронка, через которую всыпается второй реагент.
Задание 1. Определение постоянной калориметра
Теплота химической реакции, принимаемая или отдаваемая водяным калориметром, будет изменять температуру воды, находящейся в стакане Б, и температуру других частей прибора, находящихся в воде. В этом случае количество теплоты будет равно
Q = (M1C1 + M2C2) × Dt
где M1 - масса воды, С1 - теплоемкость воды, М2 и С2 - усредненные значения масс и теплоемкости для стекла стакана, мешалки и других частей калориметра.
При наполнении стакана Б и неизменности частей, погружаемых в воду, М1С1 + М2C2 = const = Z - постоянной калориметра. Таким образом,
Q = Z×Dt
из чего следует, что при Dt = 1°, Q = Z, иначе говоря, постоянная калориметра - это количество теплоты, необходимое для изменения температуры всех частей калориметра на 1°. Следовательно, до проведения эксперимента по определению теплового эффекта химической реакции Qp следует прокалибровать прибор (калориметр), т.е. определить постоянную калориметра Z. Этого можно достичь, вводя или отнимая известное количество теплоты (Qp) в данном калориметре с одновременным точным измерением изменения температуры. Тогда постоянную калориметра можно определить по формуле
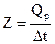
Существует большое число способов определения постоянной калориметра. В нашей работе постоянная Z устанавливается по теплоте растворения KCl.
В стакан Б калориметра наливают 400 мл дистиллированной воды. Опускают крышку калориметра так, чтобы она плотно соприкасалась с верхней частью сосуда А (рис.4). Нижняя часть термометра и мешалки при этом должны находиться на расстоянии 1-2 см от дна стакана В. Включают мотор для вращения мешалки и снимают температуру с точностью до 0,01°, пользуясь при этом лупой. Начинается предварительный период эксперимента, в течение которого записывают показания термометра через каждую минуту. Предварительный период длится 10 минут, время фиксируется по секундомеру.
На 11-ой минуте в отверстие крышки калориметра вставляется воронка, через которую в воду всыпается 7,2 г КСl. В процессе растворения КСl температура начинает резко изменяться. Начинается главный период эксперимента, в течение которого температура фиксируется через каждые полминуты.
После того как температура, достигнув минимума, начнет равномерно повышаться, начинается заключительный период эксперимента, который длится 10 минут. В заключительном периоде температура фиксируется через каждую минуту,
Полученные данные наносят на миллиметровую бумагу, откладывая по оси абсцисс время в минутах, а по оси ординат – температуру. Через точки предварительного и заключительного периодов проводят прямые линии. Из середины главного периода (точка С, рис.5) проводят перпендикуляр до пересечения с продолжением прямых предварительного и заключительного периодов (точки М и N рис. 5). Из точек пересечения опускают перпендикуляры на ось ординат. Отсекаемый отрезок на оси ординат (t1 - t2) равен Dt.
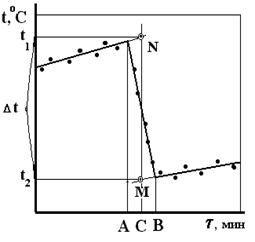 |
Рис. 5. Графическое определение Dt для вычисления постоянной калориметра.
Тепловой Qp, как ранее было сказано, вычисляется на 1 моль прореагировавшего вещества, но в данном случае в калориметре находилось g г вещества, а потому
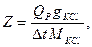
где g - навеска КСl, М – молекулярная масса для КСl, Qp в случае растворения KCl в воде равно 4440 кал/моль.
Задание 2. Определение теплового эффекта реакции окисления
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 517; Нарушение авторских прав?; Мы поможем в написании вашей работы!