
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторна робота №3
|
|
|
|
перевірка закону Фарадея для електролізу
Мета роботи: вивчення закону Фарадея для електролізу та його експериментальна перевірка.
Прилади та матеріали: аналітичні терези; реостат; вольтметр; амперметр; секундомір.
Теоретичні відомості
Вимірювальний прилад складається з посудини, заповненої водним розчином мідного купоросу (CuSO4), в який занурені мідні електроди. При проходженні електричного струму крізь розчин катіони (позитивно зарядженні іони) цього електроліту прямують до катоду; аніони (від’ємно зарядженні іони) – до аноду. На катоді катіони відновлюються до вільного металу за реакцією:
 (3.1)
(3.1)
Маса мідного катоду за рахунок цієї реакції зростає. На аноді відбувається окислення атомів міді за реакцією:
 (3.2)
(3.2)
За рахунок цієї реакції маса аноду зменшується, а концентрація електроліту лишається сталою. Постійний електричний струм при проходженні крізь електроліт здійснює електроліз. Таким чином, електроліз – це окислювально-відновлювальний процес, який відбувається на електродах при проходженні крізь електроліт постійного електричного струму.
У 1834 р. М.Фарадей експериментально встановив основні закони електролізу. Перший закон Фарадея вказує на залежність між масою речовини, яка виділилась під час електролізу і кількістю електрики, яка пройшла крізь електроліт. Цей закон формулюється так: маса речовини m, яка виділилася при електролізі, прямо пропорційна кількості електрики, яка пройшла крізь електроліт – q:
 (3.3)
(3.3)
де k − електрохімічний еквівалент речовини.
Якщо у формулі (3.3) прийняти q =1 кулону, тоді к=m, тобто електрохімічний еквівалент речовини чисельно дорівнює масі речовини, яка виділяється з електроліту при проходженні 1 кулона електрики. Для кожної речовини, яка виділяється при електролізі, електрохімічний еквівалент має певне значення.
Підставимо у формулу (3.3) значення кількості електрики як добуток сили струму I та часу t:
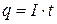 (3.4)
(3.4)
Тоді формулу (3) можна записати у вигляді:
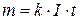 (3.5)
(3.5)
Другий закон Фарадея вказує на залежність електрохімічного еквівалента від молярної маси атомів елемента М і його валентності n. Відношення молярної маси атомів елемента до валентності називається хімічним еквівалентом простої речовини:
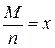 (3.6)
(3.6)
Для міді М =64; n =2.
Увівши поняття «хімічний еквівалент речовини», другий закон Фарадея можна формулювати так: електрохімічний еквівалент речовини пропорційний його хімічному еквіваленту.
 (3.7)
(3.7)
Величина С є постійною для всіх речовин, вона показує, скільки еквівалентної маси речовини виділяється на електродах при проходженні крізь електроліт 1 кулона електрики. Розрахунок показує, що для виділення еквівалентної маси речовини при електролізі необхідно, щоб крізь розчин електроліту пройшло 96500 кулонів електрики. Ця кількість електрики називається числом Фарадея, позначається F;  .
.
Другий закон Фарадея можна записати, підставляючи у формулу (3.7) значення величини з формули (3.6). Замість постійної користуються зворотною величиною F=1/С. Тоді другий закон Фарадея можна сформулювати так: електрохімічний еквівалент речовини прямо пропорційний молярній масі атомів простої речовини і обернено пропорційний валентності.
Підставляючи у формулу (3.5) значення k з формули (3.6), (3.7) та F=1/С, можна записати:
 (3.9)
(3.9)
Формула (3.9) являє собою об’єднаний закон Фарадея для електролізу. З цієї формули можна знайти І – величину сили постійного електричного струму, який пройшов крізь електроліт.
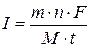 (3.10)
(3.10)
Значення сили струму за співвідношенням (3.10) визначається досить точно, оскільки F, M, n, відомі з таблиць, а похибки будуть залежати лише від точності виміру маси m та часу t. Описаний метод вимірювання сили струму дає надійні результати, які не залежать від класу точності приладів. Цей метод можна застосувати для градуювання електровимірювальних приладів та для перевірки їх показів у будь-якому місці шкали.
Порядок виконання роботи:
1) Зібрати схему за рис.3.1.
2) 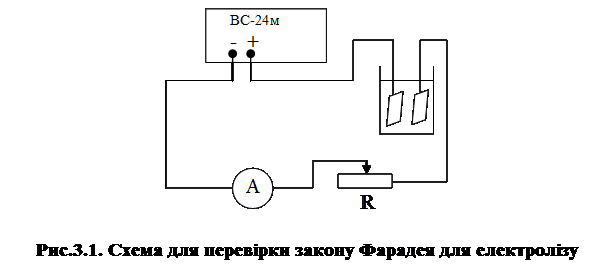 Зняти катодну пластинку, промити її, висушити та зважити на аналітичних терезах (m1) з точністю до 10-5 кг. Записати одержані результати зважування.
Зняти катодну пластинку, промити її, висушити та зважити на аналітичних терезах (m1) з точністю до 10-5 кг. Записати одержані результати зважування.
3) Під’єднати катодну пластинку та занурити її в розчин. Включити тумблер на джерелі електричного струму та одночасно пустити секундомір. Протягом 30 хв. пропускати електричний струм, підтримуючи його сталим за допомогою реостата на поділці, яку вказує викладач.
4) Розімкнути електричний ланцюг. Дістати катодну пластинку з електроліту, промити, висушити її. Знову зважити на аналітичних терезах з тією ж точністю. Записати нову масу катодної пластинки m2.
5) Розрахувати масу міді m, яка виділилася на катоді з електроліту при електролізі, за формулою: 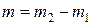 .
.
6) Визначити похибку вимірювання.
7) Розрахувати масу міді за формулою (3.9).
8) Проаналізувати отримані результати.
Контрольні запитання
1) Як залежить маса речовини, яка виділилася на електроді, від кількості електрики, що пройшла крізь електроліт?
2) Яка фізична суть електрохімічного еквівалента речовини?
3) Сформулюйте перший та другий закони Фарадея для електролізу.
4) Наведіть приклади застосування електролізу в техніці.
5) Чи можна по зміні маси катода судити про зміну маси анода?
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 776; Нарушение авторских прав?; Мы поможем в написании вашей работы!