
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы термодинамики
|
|
|
|
ЛЕКЦИЯ № 08
И биомедицинской техники
Исходный код/SVN
Этапы
Тикеты
Инструмент управления проблемами, интегрированный в приложение Assembla и постоянно обновляемый. Используйте его для задач разработки, запроса новых функций, сообщений об ошибках и планирования релизов.
Координация проекта посредством этапов и задач. Этапы требуются для инструмента Тикетов.
Репозиторий Subversion
Настройка репозитория:

Для создания вех проекта используйте пункт меню этапы (milestones)
по разделу «Молекулярная физика и термодинамика»
учебного курса «Общая физика»
для специальностей ЛП, СП, ЧМ, ХТ-5
1. Внутренняя энергия термодинамической системы.
2. Закон Больцмана о равномерном распределении энергии по степеням свободы (закон равнораспределения)
3. Первое начала термодинамики.
4. Работа газа при его расширении.
5. Равновесные и неравновесные процессы.
6. Теплоемкость.
7. Работа при изопроцессах.
8. Адиабатический процесс.
9. Уравнение Пуассона.
10. Политропические процессы.
11. Круговой процесс(цикл).
12. КПД кругового процесса.
13. Обратимый и необратимый процессы.
14. Энтропия.
15. Второе и третье начала термодинамики.
16. Тепловые двигатели и холодильные машины.
17. Теорема Карно.
18. Цикл Карно.
Составил: _____________ Т.А.Герасименко
Липецк – 2014
Основы термодинамики
1. Внутренняя энергия термодинамической системы
Внутренняя энергия U — это энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т.д.) и энергия взаимодействия этих частиц.
К внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
Внутренняя энергия — однозначная функция термодинамического состояния системы — в каждом состоянии система обладает вполне определенной внутренней энергией. Поэтому, внутренняя энергия не зависит от того, каким образом система пришла в данное состояние.
При переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода.
2. Число степеней свободы
Число степеней свободы — это число независимых переменных, полностью определяющих положение системы в пространстве.
Таблица. Число степеней свободы для идеального газа жестких
молекул (нет колеб.движ.).
| Тип газа | Одноатомный | Двухатомный | Многоатомный |

 Схема строения молекулы Схема строения молекулы
| 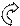       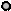
| 
| |
| Число степеней свободы одной молекулы газа - i | |||
| Поступательных | |||
| Вращательных | — | ||
| Всего |
В реальных молекулах нет жесткой связи между атомами в молекуле, поэтому необходимо учитывать также степени свободы колебательного движения атомов внутри молекулы.
Независимо от общего числа степеней свободы молекулы, три степени свободы всегда поступательные. На каждую из них приходится треть кинетической энергии поступательного движения молекулы (ε0):
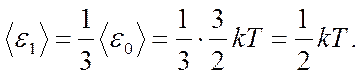
3. Закон Больцмана о равномерном распределении энергии по степеням свободы (закон равнораспределения).
Для системы, находящейся в состоянии термодинамического равновесия на каждую поступательную и вращательную степень свободы приходится в среднем кинетическая энергия, равная  , а на каждую колебательную степень свободы — в среднем энергия, равная kT.
, а на каждую колебательную степень свободы — в среднем энергия, равная kT.
Энергия колебательных степеней свободы вдвое больше, поскольку колебательная система обладает равными по величине средними значениями как кинетической, так и потенциальной энергии.
 Таким образом, средняя энергия молекулы:
Таким образом, средняя энергия молекулы:
,
где i — сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы:
i = iпост + iвращ +2·iколеб
В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы.
В идеальном газе молекулы между собой не взаимодействуют и их потенциальная энергия равна нулю. Поэтому внутренняя энергия одного моля идеального газа Uμ и произвольной массы т газа U будут соответственно:

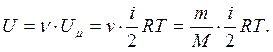
4. Первое начало термодинамики
Первое начало термодинамики - это закон сохранения и превращения энергии в термодинамических процессах.
Изменить внутреннюю энергию системы можно двумя способами: совершая над системой работу (например, сжимая газ в цилиндре с помощью поршня) или сообщая системе теплоту (например, нагревая газ в герметичном сосуде).
Рассмотрим замкнутую, макроскопически неподвижную систему, не находящуюся во внешних силовых полях и проанализируем с энергетической точки зрения равновесный процесс перехода системы из какого-либо начального состояния 1 в другое состояние 2.
Изменение внутренней энергии системы ΔU = U2 - Ul в таком процессе равно разности между количеством теплоты Q, полученным системой, и работой А, совершенной системой против внешних сил ΔU = Q - A или Q = ΔU + A.
Первое начало термодинамики:
Теплота, сообщаемая системе, расходуется на изменение ее внут- ренней энергии и на совершение ею работы против внешних сил.
В дифференциальной форме: dQ = dU + dΑ,
где dU (полный дифференциал) — бесконечно малое изменение внутренней энергии системы, dΑ — элементарная работа, dQ — бесконечно малое количество теплоты. dΑ и dQ не являются полными дифференциалами.
Дело в том, что внутренняя энергия системы является однозначной функцией состояния системы. Отсюда следует, что при совершении системой произвольного процесса, в результате которого она вновь возвращается в исходное состояние, полное изменение внутренней энергии системы равно нулю.
 .
.
Ни работа, ни теплота не являются функциями состояния системы. Все величины входящие в первое начало термодинамики могут быть как положительными, так и отрицательными.
Если к системе подводится теплота, то δQ > 0;
если от системы отводится теплота, то δQ < 0.
Если система совершает работу над внешними телами, то δΑ > 0, если же над системой внешние силы совершают работу, то δΑ < 0.
Другая формулировка первого начала термодинамики связана с тем, что если система периодически возвращается в первоначальное состояние, и следовательно ΔU = 0, то А = Q,
Т. е. вечный двигатель первого рода — периодически действующий двигатель, который совершал бы большую работу, чем сообщенная ему извне энергия, — невозможен. Т.е. невозможно, чтобы А > Q.
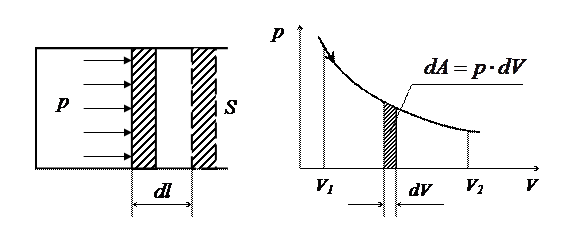
5. Работа газа при его расширении. (См. рис.)
Если находящийся под поршнем в цилиндрическом сосуде, газ, расширяясь, передвигает поршень на расстояние dl, то производит над ним работу
δΑ = Fdl = pS dl = pdV,
где S — площадь поршня.
 |
Полная работа А, совершаемая газом при изменении его объема от Vl до V2:
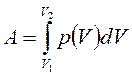
Равновесные процессы – это процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало.
Все реальные процессы неравновесны, но в ряде случаев (достаточно медленные процессы) неравновесностью реальных процессов можно пренебречь.
Равновесные процессы можно изображать графически в координатах (p,V). Так работа δΑ = p ∙ dV определяется площадью заштрихованной полоски, аполная работа — площадью под кривой между V1 и V2.
При неравновесных процессах значения параметров в разных частях системы различны и не существует (p,V) -точек, характеризующих состояние всей системы. Поэтому графическое изображение неравновесного процесса невозможно.
 6.Теплоемкость
6.Теплоемкость
Теплоемкость тела – это кол. тепла, необх. для нагревания его на 1К.
6.1. Удельная теплоемкость вещества с — величина, равная количеству теплоты, необходимому для нагревания 1кг вещества на 1 К.
Единица удельной теплоемкости — Дж/(кг К)
 |
6.2.Молярная теплоемкость сμ — величина, равная количеству теплоты, необходимому для нагревания 1моль вещества на 1К. Единица молярной теплоемкости — Дж/(моль К).

Связь между сμ и с: сμ = с·М
Различают теплоемкости (удельную и молярную) при постоянном объеме (сv и С v) и при постоянном давлении (ср и СР), если в процессе нагревания вещества его объем или давление поддерживаются постоянными.
6.2.1. Молярная теплоемкость при постоянном объеме (CV)
Из первого начала термодинамики dQ = dU + dA,
с учетом 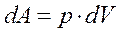 и
и  ,
,
для 1 моля газа получим:

При V = const работа внешних сил δΑ равна нулю и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии (dVμ = 0).
Cv равна изменению внутренней энергии одногомоля газа при повышении его температуры на 1 К.
Поскольку dUμ = 1/2RdT, то Cv = i/2∙R
Если 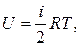 то
то  , тогда
, тогда  или
или

|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 487; Нарушение авторских прав?; Мы поможем в написании вашей работы!