
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адресование белков
|
|
|
|
Синтезированные пробелки (полипептиды) или сформировавшиеся зрелые белки должны быть правильно размещены в клетке или выделены из нее на экспорт. Распределением белков (направлением их по заданному адресу) управляют механизмы адресования белков. Эти механизмы достаточно сложны и для каждого белка имеют свои особенности. Однако, существуют и общие черты в процессах адресования различных белков.
В структуре полипептидной цепи выделяют сигнальный участок, который содержит условный адрес размещения данного белка. Функцию сигнального участка выполняет фрагмент аминокислотной последовательности белка. В зависимости от аминокислотного состава сигнального участка, белок направляется в какой-либо компартмент клетки. Например, неполярные аминокислотные остатки сигнального участка обеспечивают транспорт белка в липидный бислой мембран, полярные - способствуют распределению белка в цитоплазму клетки.
третьей рибосомы и так далее. Количество рибосом в полисоме определяется длиной мРНК, т.к. в связи с большими размерами рибосом минимальное расстояние между ними на мРНК составляет 80 нуклеотидов.
В образованной 80S рибосоме выделяют два участка (сайта): пептидильный (место, в котором осуществляется образование пептидных связей) - Р-участок и аминоацильный (место присоединения аа-тРНК) - А-участок. В завершение инициации мет-тРНК занимает область Р-участка, А-участок - свободен.
После этого начинается элонгация.
II Элонгация (продолжение трансляции) включает три последовательные фазы.
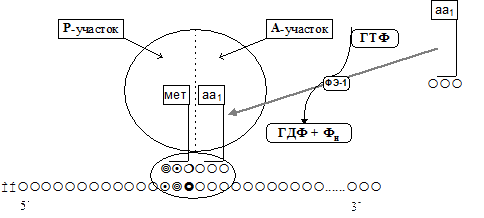
1) Присоединение к следующему кодону мРНК соответствующей ему аа-тРНК. Белковый фактор элонгации - 1 (ФЭ-1) образует комплекс с ГТФ и молекулой аа-тРНК, что обусловливает присоединение аа-тРНК к рибосоме (рис. 9).
Взаимодействие происходит в А-участке рибосомы и обеспечивается энергией ГТФ. Антикодон аа-тРНК комплементарно связывается с кодоном мРНК.
Рис. 9
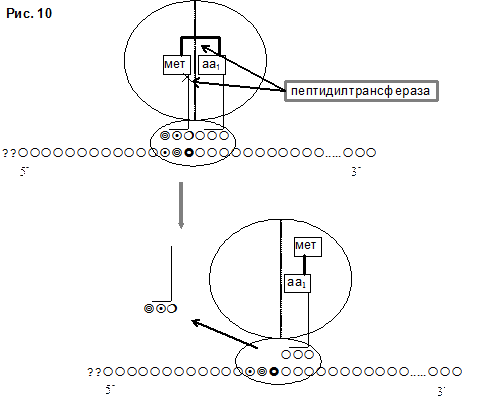
2) Пептизация с формированием пептида в А-участке и освобождением Р-участка рибосомы от предыдущей аа-тРНК
Аминогруппа новой аа-тРНК (поступившей в А-участок) и карбоксильная группа предыдущей аа-тРНК (находящейся в Р-участке) образуют пептидную связь. Реакция обеспечивается пептидилтрансферазой - ферментом 60S рибосомы, который катализирует процесс образования пептидной связи, а также разрыв сложноэфирной связи между тРНК и аминокислотой Р-участка. При этом, растущий пептид в виде пептидил-тРНК оказывается в А-участке. В Р-участке находится тРНК, освободившаяся от аминокислоты, которая быстро покидает рибосому (рис. 10).
3) Транслокация. При транслокации происходит перемещение рибосомы (но не пептидил-тРНК) на один кодон в направлении 3`-конца мРНК. А-участок рибосомы становится свободным, а в Р-участке теперь находится пептидил-тРНК (осуществляется внутририбосомный переход пептидил-тРНК). Для транслокации необходимы: белковый фактор элонгации - 2 (ФЭ-2)иэнергия ГТФ (рис. 11).

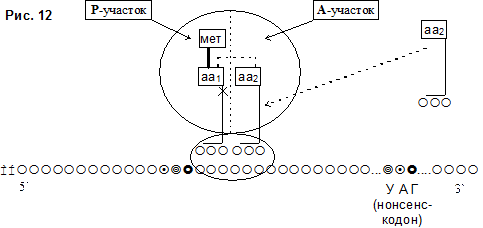
Таким образом, освобождение А-участка делает возможным новый цикл элонгации с присоединением следующей молекулы аа-тРНК (аа2-тРНК, рис.12), соответствующей следующему кодону мРНК.
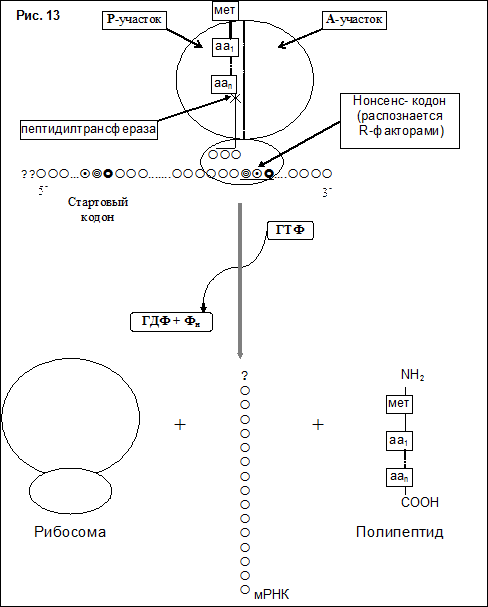
Когда в А-участке рибосомы появляется кодон мРНК, не имеющий смысла (нонсенс или терминирующий кодон), дальнейшее удлинение полипептидной цепи становится невозможным. Элонгация прекращается и наступает терминация
III Терминация. Терминирующий кодон распознается специальными белковыми факторами высвобождения (R-факторы, от англ.: to release - освобождать). Название данных факторов обусловлено тем, что в результате их действия из рибосомы высвобождаются полипептид, тРНК и мРНК. Гидролиз сложноэфирной связи между полипептидом и тРНК осуществляет фермент пептидилтрансфераза. На этапе терминации затрачивается энергия одной фосфатной связи ГТФ (рис. 13).
Существуют механизмы повышения эффективности трансляции.
- Многократная трансляция на рибосоме одной и той же мРНК. Матричный полинуклеотид может повторно использоваться для синтеза полипептидной цепи. Таким образом, несколько копий полипептида тиражируются с одной РНК-матрицы, что экономит ресурсы, требующиеся для синтеза мРНК.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1332; Нарушение авторских прав?; Мы поможем в написании вашей работы!