
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Cl Be Cl
|
|
|
|
Типы гибридизации АО и структура молекул
Если у атома в образовании химических связей участвуют разные по типу АО (s-, p-, d- или f-АО), то химические связи формируются электронами не «чистых», а «смешанных», или гибридных орбиталей.
Перекрывание гибридных АО происходит в большей степени, чем негибридных орбиталей Þ
► химические связи прочнее
► молекула более устойчива.
Гибридная орбиталь:
 |
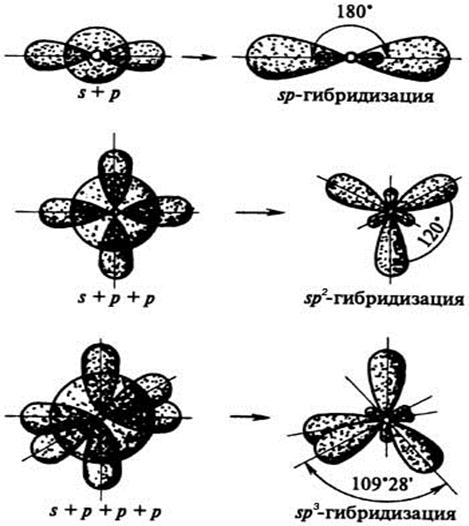
| Орбитали, участвующие в гибридизации | Тип гибридизации | Структура молекулы | Валентный угол |
| s +p | sp |  Линейная
Линейная
| 180о |
| s+p+p | sp2 |  плоский треугольник
плоский треугольник
| 120о |
| s+p+p+p | sp3 |  тетраэдр
тетраэдр
| 109,3о |
Молекула ВеСl2

■ sp -гибридизация АО Ве, Ð180о
■ пространственная структура Þ линейная.

■ связь полярная m св ¹ 0, т.к. ЭО Ве и Cl: 1,5 и 3,0
Þ Cl Be ® Cl
■ m мол = S m св = 0 Þ молекула в целом неполярная.
Молекула ВН3
 |
В* 2 s1 2 p2
|
|
|
|
|
Дата добавления: 2014-12-23; Просмотров: 480; Нарушение авторских прав?; Мы поможем в написании вашей работы!