
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионные кристаллы - гигантские полимерные молекулы
|
|
|
|
В гибридизации могут участвовать вакантные АО, АО с неподеленными парами электронов и АО с неспаренными электронами.
● Неподеленные электронные пары (НП) влияют на величину валентных углов Þ силы отталкивания между ними больше, чем между относительно закрепленными электронными парами образующими связь (связывающая электронная пара - СП).
● Уменьшение силы отталкивания электронных пар:
НП-НП > НП-СП > СП-СП
В молекуле NН3 одна НП уменьшает тетраэдрический угол (109,3о) до 107о, а в молекуле Н2О две НП уменьшают его до 104,5о.
 | |||
|
Ионная связь не обладает
: ▼ Каждый ион окружен сферическим электрическим полем, действующим на любой другой ион.
▼ Сила взаимодействия ионов определяются величиной их заряда и расстоянием между ними по закону Кулона.
▼ Ион окружает себя наибольшим числом ионов противоположного заряда в определенном порядке, позволяющем занять минимально возможный объем с минимальной потенциальной энергией.
▼ Понятие валентности к ионной связи неприменимо.
Чисто ионная связь не существует - доля ионности связи (Na+0.9Cl-0.9)
▼ Ионные связи - прочные.
▼ Твердые кристаллические вещества ионного типа - тугоплавкие, высокопрочные, но хрупкие, растворяются в полярных растворителях (в Н2О).
Формулы (NаСl, СаF2, Аl2(SО4)3) - отражают лишь состав.


Силы И.Ван-дер-Ваальса (голланд.ученый, 1873 г.) – силы межмолекулярного взаимодействия (взаимодействия между молекулами), проявляющиеся на расстояниях, превосходящих размеры частиц.

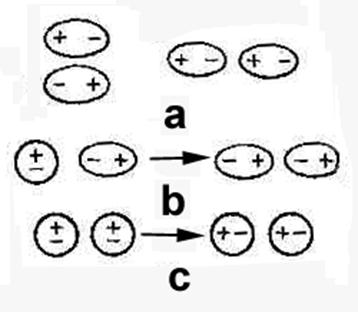
1. ОРИЕНТАЦИОННАЯ СОСТАВЛЯЮЩАЯ ИЛИ ДИПОЛЬ-ДИПОЛЬНОЕ ВЗАИМОДЕЙСТВИЕ (эффект Кьезома) – электростатическое взаимодействие полярных молекул при сближении (рис.а)
Еориен увеличивается с увеличением m мол и уменьшением расстояния между молекулами.
 |
|
3. дисперсионная составляющая (эффект Лондона)
-электростатическое взаимодействие мгновенных диполей, возникающих за счет флуктуации (случайное отклонениие от нормального значения) электрической плотности (рис.с). В результате взаимодействия мгновенных диполей энергия системы понижается.
Едисп пропорциональна поляризуемости молекул и обратно пропорциональна расстоянию между центрами частиц.
Для неполярных молекул - единственная составляющая вандерваальсовых сил.
| вещество | m диполя | Поляризуемость, М3×1030 | Энергия взаимодействия, кДж/моль | Ткип,К | |||
| ориентационная | Индукционная | Дисперсионная | Суммарная | ||||
| H2 Ar Xe HCl HBr HI NH3 | 1,03 0,78 0,38 1,52 | 0,8 1,64 4,16 2,64 3,62 5,42 2,23 | 3,3 1,1 0,6 13,3 | 1,0 0,70 0,3 1,5 | 0,17 8,5 18,4 16,8 28,5 60,6 14,7 | 0,17 8,5 18,4 21,1 30,3 61,5 29,5 | 20,2 239,6 |
Минимальная энергия системы обеспечивается при расстояниях между центрами молекул 0,4 – 0,5 нм, т. е. существенно больше длины химической связи.
Как видно из табл., с увеличением размера молекул в ряду Аr – Хе и НСl – НI растет их поляризуемость и энергия дисперсионного притяжения. Ориентационное взаимодействие вносит значительный вклад в вандерваальсовы силы для молекул с большим m дип. ]
С увеличением åЕ возрастет Ткип жидкостей, а также теплота их испарения.

|
 |  |
|
|
|
|
|
Дата добавления: 2014-12-23; Просмотров: 501; Нарушение авторских прав?; Мы поможем в написании вашей работы!