
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЗWake UpИ 38 страница
|
|
|
|
Масса выделившейся меди: 64n
Увеличение массы пластинки: 207n - Аn
Уменьшение массы пластинки: Аn - 64n (n - число молей)
Пусть масса пластинки – m, тогда:
m составляет 100%
(207n - Аn) составляет 9,5%
m = (207n - Аn) · 100%: 9,5%
m составляет 100%
(Аn - 64n) составляет 4,8%
m = (Аn - 64n) · 100%: 4,8%
По условию задачи
(207n - Аn) · 100%: 9,5% = (Аn - 64n) · 100%: 4,8%
А = 112, металл кадмий – Сd
Задача 5.
Белый нерастворимый в кислой среде осадок, выпадающий при добавлении Ba(NO3)2, является сульфатом BaSO4. Следовательно, купоросы – соли серной кислоты.
При нагревании до 300°С может удаляться кристаллизационная вода. Следовательно, купоросы – это кристаллогидраты сульфатов двухвалентных металлов.
Представим формулу Х в виде MSO4 · n H2O.
Прокаливание 3,000 г Х привело к потере 3,000 · 0,374 = 1,122 г воды, что соответствует 1,122:18,02 = 0,06226 моль Н2О.
В осадок выпало 2,904:233,40 = 0,01244 моль BaSO4.
Очевидно, что число молей купороса такое же. Следовательно, на моль купороса приходится 0,06226: 0,01244 = 5 моль Н2О, то есть n = 5.
Молярная масса купороса Х равна 3,000: 0,01244 = 241,15 г/моль.
Молярную массу купороса Х можно представить в виде М(Х) = М(М) + M(SO4) + n M(H2O), где М(М) – молярная масса металла М. Отсюда М(М) = 241,15 – 96,06 − 5 · 18,02 = 54,99. Это – марганец.
Таким образом, формула искомого купороса купороса – MnSO4 · 5H2O.
Уравнения реакций:
MnSO4 · 5H2O = MnSO4 + 5H2O↑
MnSO4 + Ba(NO3)2 = Mn(NO3)2 + BaSO4↓.
Задача 1
Анализ брутто-формл позволил определить строение веществ А-Г:
А – H2O5С Cu2 - (CuОH)2CO3 – карбонат гидроксомеди, основная соль.
Б – O2Cl2Ca – Ca(ClО)2 – гипохлорит кальция, средняя соль.
В – H8O7N2Cr2 - (NH4)2Cr2O7 –- дихромат аммония, средняя соль.
Г – H4O8P2Mg - Mg(H2PO4)2 - дигидроортофосфат магния, кислая соль.
Уравнения характерных реакций:
А: (CuOH)2CO3 = 2 CuO + H2O ↑ + СО2 ↑ (нагрев.) или
(CuOH)2CO3 + 4HCl = 2CuCl2 + 3H2O + СО2 ↑ (об.усл.)
Б: Ca(ClО)2 + 4HCl = CaCl2 + 2Cl2↑ + 2H2O (об.усл.) или
Ca(ClО)2 + СО2 + H2O = CaCO3↓ + 2НOCl
В: ( NH4)2Cr2O7 + 4NaOH = 2Na2CrO4 + 2NH3 ↑ + 3H2O (об.усл.) или
( NH4)2Cr2O7 = N2 ↑ + Cr2O3 + 4H2O ↑ (нагрев.)
Г: 3Mg (H2PO4)2 + 12NaOH = Mg3(PO4)2↓ + 4Na3PO4 + 12H2O (об.усл.)
Задача 2
Уравнения протекающих реакций:
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
2H3PO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 6H2O
Из этих уравнений можно составить стехиометрическую схему:
2P→Ba3(PO4)2
из 62 г фосфора получается 601 г фосфата бария
из 7,5 г фосфора получается х г фосфата бария
отсюда теоретическая масса фосфата бария равна:
(7,5·601): 62 = 72,7(г).
Практический выход осадка: 61,7: 72,7= 0,849 или 84,9%.
Задача 3
М (Na2SO4) = 142 (г/моль)
М (Na2SO4·10H2O) = 322 (г/моль)
Находим соотношение между массой «свободной» воды и массой кристаллогидрата в 100 г 5%-ного раствора:
Пересчитаем массу Na2SO4 на массу кристаллогидрата Na2SO4·10H2O.
В 322 г Na2SO4·10H2O содержатся 142 г Na2SO4
В 57,4 г Na2SO4·10H2O содержатся х г Na2SO4
Масса Na2SO4 равна: (57,4: 322)·142 = 25,31(г).
Находим массу 5%-ного раствора, в которой должен содержаться безводный Na2SO4:
25,31: 0,05 = 506,26 (г).
Из этой массы раствора вычитаем массу исходного кристаллогидрата и получаем необходимую массу воды:
506,26 – 57,4 = 448,86 (г).
Масса воды необходимая для получения раствора равна 448,86 (г).
Задача 4
Pb2+ + Me = Pb + Me2+ (1)
А 207
Cо2+ + Me = Cо + Me2+ (2)
А 59
Увеличение массы пластинки может происходить тогда, когда атомная масса исходного металла будет меньше атомной массы вытесняемого металла (в данном свинца), а уменьшение массы пластинки тогда, когда атомная масса исходного металла больше атомной массы вытесняемого металла.
Таким образом, по реакции (1) увеличение массы составляет (207 – А), а по реакции (2) уменьшение массы составляет (А – 59), где А – атомная масса неизвестного металла.
Масса выделившегося свинца: 207n
Масса выделившегося кобальта: 59n
Увеличение массы пластинки: 207n - Аn
Уменьшение массы пластинки: Аn - 59n (n - число молей)
Пусть масса пластинки – m, тогда:
m составляет 100%
(207n - Аn) составляет 1,42%
m = (207n - Аn) · 100%: 1,42%
m составляет 100%
(Аn - 59n) составляет 0,06%
m = (Аn - 59n) · 100%: 0,06%
По условию задачи
(207n - Аn) · 100%: 1,42% = (Аn - 59n) · 100%: 0,06%
А = 65, металл цинк – Zn
Задача 5.
Белый нерастворимый в кислой среде осадок, выпадающий при добавлении BaCl2, является сульфатом BaSO4. Следовательно, купоросы – соли серной кислоты.
При нагревании до 300°С может удаляться кристаллизационная вода. Следовательно, купоросы – это кристаллогидраты сульфатов двухвалентных металлов.
Представим формулу Х в виде MSO4 · n H2O.
Прокаливание 2,000 г Х привело к потере 2,000 · 0,449 = 0,898 г воды, что соответствует 0,898:18,02 = 0,0498 моль Н2О.
В осадок выпало 1,662:233,40 = 0,00712 моль BaSO4.
Очевидно, что число молей купороса такое же. Следовательно, на моль купороса приходится 0,0498: 0,0712 = 7 моль Н2О, то есть n = 7.
Молярная масса купороса Х равна 2,000: 0,00712 = 280,90 г/моль.
Молярную массу купороса Х можно представить в виде М(Х) = М(М) + M(SO4) + n M(H2O), где М(М) – молярная масса металла М. Отсюда М(М) = 280,90 – 96,06 − 7 · 18,02 = 58,70. Это – никель.
Таким образом, формула искомого купороса купороса – NiSO4 · 7H2O.
Уравнения реакций:
NiSO4 · 7H2O = NiSO4 + 7H2O↑
NiSO4 + BaCl2 = NiCl2 + BaSO4↓.
Задача 1.
KNO3 + H2SO4 = HNO3 + KHSO4
BaSO3 = BaO + SO2
AlCl3 + 3H2O = Al(OH)3 + 3HCl (возможно также написание основных хлоридов алюминия)
СО2 (тв.) = СО2 (газ)
Задача 2.
Один из возможных вариантов:
Источник иода – водоросли. В золе после сгорания водорослей содержатся иодиды калия и натрия. Иод может быть получен электролизом водной суспензии золы с инертными электродами.
Гидроксид натрия легко получить электролизом водного раствора каменной соли.
При растворении иода в щелочи получается смесь иодида и иодата.
Реакции:
2MI + 2H2O = 2MOH + H2 + I2 (электролиз)
2NaCl + 2H2O = 2NaOH + H2 + Cl2 (электролиз)
6NaOH + I2 = NaI + NaIO3 + 3H2O
Задача 3.
При взаимодействии металлов с очень разбавленной азотной кислотой возможно три варианта:
а) Me + HNO3 ® Me(NO3)x + NO
б) Me + HNO3 ® Me(NO3)x + N2
в) Me + HNO3 ® Me(NO3)x + NH4NO3
Реакции (а) и (б) относятся к случаю малоактивных металлов, а реакция (в) будет протекать в случае активных металлов.
В случаях (а) и (б) при прокаливании сухого остатка будет происходить разложение нитрата либо до оксида металла, кислорода и диоксида азота, либо до металла, кислорода и диоксида азота.
Me(NO3)x = MeOx/2 + xNO2 + x/4O2
Из 1 моль нитрата получается 1,25x моль газообразных продуктов.
Тогда получаем: 1,92: 22,4 = 0,0857 = 4 · 1,25 · х: М
М = 58,34х – таких металлов нет
Me(NO3)x = Mе + xNO2 + x/2O2
Из 1 моль нитрата получается 1,5x моль газообразных продуктов.
Тогда получаем: 0,0857 = 4 · 1,5 · х: М
М = 70,01х – таких металлов нет
В случае (в) сухой остаток будет смесью нитрата металла и нитрата аммония. При прокаливании нитрата такого металла он будет разлагаться на нитрит и кислород или на оксид металла и диоксид азота, а нитрат аммония - на азот, кислород и воду (N2O при данной температуре термически неустойчив). Рассмотрим первый вариант
Ме + 5x/4HNO3 = Me(NO3)x + x/8NH4NO3 + 3x/8H2O
Me(NO3)x = Me(NO2)x + x/2O2
2NH4NO3 = 2N2 + О2 + 4H2O
Таким образом, на 1 моль металла приходится 0,9375х моль газов.
0,0857 = 4 · 0,9375 · х: М
М = 43,76х. При х = 2 М = 87,52 г/моль, металл – стронций.
Задача 4.
Условием осуществления процесса получения металла из его оксида методом металлотермии является экзотермичность соответствующей реакции восстановления
xМg + M’Ox = xMgO + M’
Тепловой эффект этой реакции легко рассчитать по закону Гесса:
Q = xQобр(MgO) – Qобр(M’Ox)
Тогда получаем:
| Металл | Х | Q, кДж/моль | |
| Ca | -33 | Эндо | |
| Ga | 1,5 | -7 | Эндо |
| La | 1,5 | 5,5 | Экзо |
| Ti | Экзо | ||
| Zn | Экзо |
Таким образом, из приведенных металлов методом магнийтермии могут быть получены лантан, титан и цинк.
Препятствовать получению металла данным методом могут процессы образования твердых растворов и сплавов, снижающие чистоту продукта.
Задача 5.
Пусть M(Hal) = x г/моль, тогда по результатам анализа можно получить соотношение элементов в X-Hal:
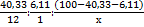 = 3,36: 6,11: 53,56/x = x/15,94: x/8,77: 1.
= 3,36: 6,11: 53,56/x = x/15,94: x/8,77: 1.
| Hal | M(Hal) = x, г/моль | Соотношение |
| F | 1,19: 2,17: 1 | |
| Cl | 35,5 | 2,23: 4,05:1 |
| Br | 5,02: 9,12: 1 | |
| I | 7,97: 14,48:1 |
По химическому смыслу подходит только вариант с бромом: C5H9Br (X – C5H10 – удовлетворяет формуле СnH2n, соответствующей алкенам или циклоалканам)
Исходя из этой формулы, получим теоретические значения: ω(С) = 40,29% и ω(Н) = 6,10%. Следовательно, Δ(C) = 100 · (40,33-40,29): 40,29 = 0,1%.
Δ(H) = 100 · (6,11-6,10): 6,10 = 0,16%.
Всего существует 12 изомерных углеводородов:
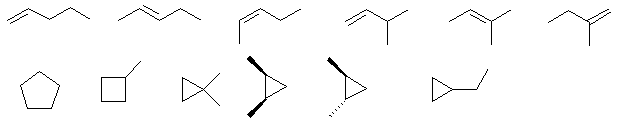
По 6 моногалогенпроизводных имеют пентен-1 и метилциклобутан:
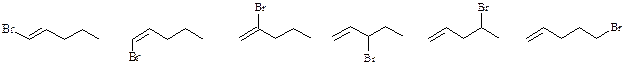

По 3 моногалогенпроизводных имеют 2-метилбутена-2 и транс -1,2-диметилциклопропан:

2 моногалогенпроизводных имеет 1,1-диметилциклопропан:

Задача 6.
По схеме реакций получается:С6Н12 → С6H12-nBrn →nAgBr
Числа моль циклогексана и бромида серебра равны, соответственно: 10,5:84,18=0,1247 и 35,10:187,77=0,1869, а их отношение: 0,1869:0,1247=1,50. Это означает, что продукт представляет собой смесь 1:1 по молям моно- и дибромциклогексана.
Задача 1.
NH4NO3 = N2O + 2H2O
CH4 = C + 2H2 или
2CH4 = C2Н2 + 3H2
2BaO2 = 2BaO + O2
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Задача 2.
Бром содержится в морской воде в виде бромид-ионов и легко может быть вытеснен хлором (отделить от иода можно путем охлаждения и последующего выделения кристаллов иода). Хлор для этих целей легко получить электролизом раствора хлорида калия, встречающегося в природе в виде минерала сильвина. При последующем растворении брома в щелочи получается смесь бромида и бромата.
Реакции:
2KCl + 2H2O = 2KOH + H2 + Cl2 (электролиз)
Cl2 + 2NaBr = 2NaCl + Br2
6KOH + Br2 = KBr + KBrO3 + 3H2O
Задача 3.
При взаимодействии металлов с очень разбавленной азотной кислотой возможно три варианта:
а) Me + HNO3 ® Me(NO3)x + NO
б) Me + HNO3 ® Me(NO3)x + N2
в) Me + HNO3 ® Me(NO3)x + NH4NO3
Реакции (а) и (б) относятся к случаю малоактивных металлов, а реакция (в) будет протекать в случае активных металлов.
В случаях (а) и (б) при прокаливании сухого остатка будет происходить разложение нитрата либо до оксида металла, кислорода и диоксида азота, либо до металла, кислорода и диоксида азота.
Me(NO3)x = MeOx/2 + xNO2 + x/4O2
Из 1 моль нитрата получается 1,25x моль газообразных продуктов.
Тогда получаем: 1,53: 22,4 = 0,0683 = 5 · 1,25 · х: М
М = 91,5х – таких металлов нет
Me(NO3)x = Mе + xNO2 + x/2O2
Из 1 моль нитрата получается 1,5x моль газообразных продуктов.
Тогда получаем: 0,0683 = 5 · 1,5 · х: М
М = 109,81х – таких металлов нет
В случае (в) сухой остаток будет смесью нитрата металла и нитрата аммония. При прокаливании нитрата такого металла он будет разлагаться на нитрит и кислород или на оксид металла и диоксид азота, а нитрат аммония - на азот, кислород и воду (N2O при данной температуре термически неустойчив). Рассмотрим первый вариант
Ме + 5x/4HNO3 = Me(NO3)x + x/8NH4NO3 + 3x/8H2O
Me(NO3)x = Me(NO2)x + x/2O2
2NH4NO3 = 2N2 + О2 + 4H2O
Таким образом, на 1 моль металла приходится 0,9375х моль газов.
0,0683 = 5 · 0,9375 · х: М
М = 68,63х
При х = 2 М = 137,26 г/моль, металл – барий.
Задача 4.
Условием осуществления процесса получения металла из его оксида методом металлотермии является экзотермичность соответствующей реакции восстановления
xAl + 1,5M’Ox = x/2Al2O3 + 1,5M’
Тепловой эффект этой реакции легко рассчитать по закону Гесса:
Q = x/2Qобр(Al2O3) – 1,5Qобр(M’Ox)
Тогда получаем:
| Металл | Х | Q, кДж/моль | |
| Mg | -65 | эндо | |
| Sn | 804,5 | Экзо | |
| In | 1,5 | Экзо | |
| Cr | 1,5 | 267,5 | Экзо |
| Cd | экзо |
Таким образом, из приведенных металлов методом алюминотермии могут быть получены олово, индий, хром и кадмий.
Препятствовать получению металла данным методом могут процессы образования твердых растворов и сплавов, снижающие чистоту продукта.
Задача 5.
Пусть M(Hal) = x г/моль, тогда по результатам анализа можно получить соотношение элементов в X-Hal:
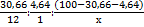 = 2,56: 4,64: 64,70/x = x/25,27: x/13,94: 1.
= 2,56: 4,64: 64,70/x = x/25,27: x/13,94: 1.
| Hal | M(Hal) = x, г/моль | Соотношение |
| F | 0,75: 1,36: 1 | |
| Cl | 35,5 | 1,40: 2,55:1 |
| Br | 3,17: 5,74: 1 | |
| I | 5,03: 9,11:1 |
По химическому смыслу подходит только вариант с иодом: C5H9I (X – C5H10 – удовлетворяет формуле СnH2n, соответствующей алкенам или циклоалканам)
Исходя из этой формулы, получим теоретические значения: ω(С) = 30,63% и ω(Н) = 4,64%. Следовательно, Δ(C) = 100 · (30,66-30,63):30,63 = 0,1%.
Δ(H) = 100 · (4,64-4,64):4,64 = 0,0%. (Водород определен точно).
Всего существует 12 изомерных углеводородов:

По 6 моногалогенпроизводных имеют пентен-1 и метилциклобутан:
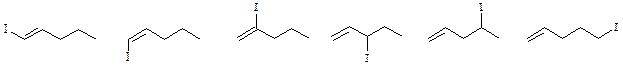

По 3 моногалогенпроизводных имеют 2-метилбутена-2 и транс -1,2-диметилциклопропан:

2 моногалогенпроизводных имеет 1,1-диметилциклопропан:
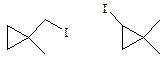
Задача 6.
По схеме реакций получается:С6Н12 → С6H12-nCln →nAgCl
Числа моль циклогексана и хлорида серебра равны, соответственно: 5,5:84,18=0,0653 и 14:143,32=0,0977, а их отношение: 0,1869:0,1247=1,50. Это означает, что продукт представляет собой смесь 1:1 по молям моно- и дихлорциклогексана.
Задача 1.
Один из возможных вариантов:
С + O2 = CO2
CO2 + 2NaOH = Na2CO3 + H2O
Na2CO3 + CaCl2 = 2NaCl + CaCO3
CaCO3 + 4C = CaC2 + 3CO
CaC2 + 2H2O = Ca(OH)2 + H2C2
Задача 2.
Из бинарных соединений кальция при взаимодействии с водой газ будут образовывать гидрид, карбид, нитрид, фосфид. Соответственно, продуктами взаимодействия с водой могут быть водород, ацетилен, аммиак и фосфин. Поскольку относительная плотность выделяющегося при взаимодействии с селенистой кислотой газа равна 0,85, молярная масса этого газа составляет М = 0,85 · 40 = 34 г/моль. Данному условию отвечает фосфин, РН3.
По-видимому, второй газ поглощается кислотой. Из указанных выше вариантов основные свойства проявляет только аммиак. Следовательно, исходная смесь состояла из фосфида и нитрида кальция.
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3
Ca3P2 + 3H2SeO3 = 3CaSeO3 + 2PH3
Ca3N2 + 4H2SeO3 = 3CaSeO3 + (NH4)2SeO3
Определим мольное соотношение нитрида и фосфида кальция. Пусть мольная доля аммиака в смеси газообразных продуктов составляет х. Тогда:
17х + 34·(1-х) = 0.65·40 = 26
Х = 0,47, т.е., на 0,47 моль нитрида кальция приходится 0,53 моль фосфида.
Тогда массовая доля нитрида кальция составит
0,47 · 148:(0,47 · 148 + 0,53 · 182) = 41,9%
Массовая доля фосфида кальция – 58,1%.
Задача 3.
При электролизе будет протекать процесс:
2HCl = H2 + Cl2
Полученный хлор будет взаимодействовать с гидроксидом бария:
2Ba(OH)2 + 2Cl2 = BaCl2 + Ba(ClO)2 + 2H2O
6Ba(OH)2 + 6Cl2 = 5BaCl2 + Ba(ClO3)2 + 6H2O
Следует отметить, что массы образующихся солей в обоих случаях одинаковы.
В исходном растворе хлороводорода присутствовало 250 · 1,05 · 0,10: 36,5 = 0,72 моль HCl. Для получения 1 моль хлора требуется 96500 · 2 = 193000 Кл. По условию задачи через раствор пропустили 5 000 Кл электричества, следовательно, хлороводород в недостатке. В результате электролиза получилось 5000: 193000 = 0,026 моль хлора.
В баритовой воде присутствовало 300 · 0,05: 171,3 = 0,088 моль гидроксида бария. По-видимому, хлор взят в недостатке. Тогда в результате реакции получится 0,044 моль хлорида бария и 0,044 моль гипохлорита бария или 0,0073 моль хлорида и 0,0367 моль хлората или смесь хлорида, хлората и гипохлорита. Также останется непрореагировавший гидроксид бария в количестве 0,036 моль
Масса продукта при этом составит
m = 0,044 · 208,3 + 0,044 · 240,3 + 0,036 · 171,3 = 25,91 г
Задача 4.
Запишем кинетическое уравнение реакции.
V = k[CH3CHO]2
Повышение давления равнозначно увеличению концентрации газообразных веществ. Следовательно, концентрация увеличилась в 1,52: 1,1 = 1,382 раза.
V’ = k[CH3CHO]’2 = k∙1,3822[CH3CHO]2 = 1,91V
По условию также уменьшили температуру на 10 oС. По правилу Вант-Гоффа:
V’ = V∙gDT/10 = V∙2,2-1 = 0,4545V
В результате скорость реакции увеличится в 1,91∙0,4545 = 0,87 раза (< 1). Т.е. скорость реакции уменьшится в 1: 0,87 = 1,15 раза.
Схема катализа:
СН3СНО + I2 → СН3I + НI + СО
СН3I + НI → СН4 + I2
Ответ: скорость реакции уменьшится в 1,15 раза.
Задача 5.
Кислотная дегидратация спиртов приводит к образованию алкенов или простых эфиров (только в случае первичных спиртов). Рассмотрим возможные случаи образования продуктов в температурном интервале нагревания до 140 oС (тогда исключается возможность образования алкенов из первичных спиртов):
1) первичный (1)/первичный (2) – эфир (1), эфир(2), эфир (3) – продукт перекрестной дегидратации: образуется 3 продукта, противоречит условию;
2) вторичный (1)/ вторичный (2) – алкен (1), алкен (2); для случаев третичный (1)/третичный (2) и вторичный/третичный аналогично: массовая доля углерода 12n: 14n = 6/7 есть величина постоянная для любого алкена (CnH2n), противоречит условию;
3) первичный/ вторичный – эфир, алкен; для случая первичный/третичный аналогично – удовлетворяет условию.
Легко показать, что массовая доля углерода в любом эфире всегда меньше, чем в алкене. Общая формула эфира CnH2n+2O, ω(C) = 12n: (14n + 18) = 6/7 – 0,119. Решая это уравнение, получим n = 8. В спирте число атомов углерода в 2 раза меньше. Таким образом, один из спиртов н-C4H9OH.
ω(C в н-C4H9OH) = 100∙12∙4:74 = 64,9%, тогда ω(C в CmH2m + 2O) = (64,9 ± 4,9)% = 100∙12m:(14m + 18). Решая два уравнения, получим, m = 5,5 и m = 3. m должно быть натуральным числом, т.е. m = 3. Второй спирт – i-C3H7OH.
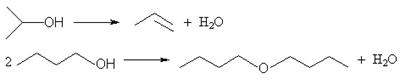
Задача 6.
Пусть Х – доля минорного компонента. По выражению для константы равновесия: 0,25=Х:(1-Х), Х=0,2, т.е 20% и 80%. Наиболее термодинамически стабилен 2-хлорпропан, он будет в избытке.
Одним из удобных способов синтеза является следующий:
CaC2 + 2H2O = HC≡CH + Ca(OH)2
Al4C3 + 12HCl = 3CH4 + 4AlCl3
CH4 + Br2 = CH3Br
HC≡CH + NaNH2 = HC≡CNa + NH3 (вместо NaNH2 можно использовать Na)
HC≡CNa + CH3Br = HC≡CCH3 + NaBr
HC≡CCH3 + H2 = H2C=CHCH3 (реакция идет в присутствии каталитически активного Pd)
H2C=CHCH3 + HCl = H3CCHClCH3
Однако возможны и другие пути синтеза.
Задача 1.
Один из возможных вариантов:
С + O2 = CO2
CO2 + Ca(OH)2 = CaCO3 + H2O
CaCO3 + 3C = CaC2 + 3CO
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 372; Нарушение авторских прав?; Мы поможем в написании вашей работы!