
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реагенты
|
|
|
|
Приготовление 0,1 М раствора NaOH
II. Установление концентрации раствора NaOH
В чистую колбу вместимостью 250 мл вносят рассчитанную массуNaOH, необходимую для приготовления раствора с концентрацией 0,1М, предварительно взвесив щелочь на кальке на технохимических весах, и тщательно перемешивают.
HCl, 0,1000 М раствор;
NaOH 0,1М раствор;
Индикатор метиловый оранжевый.
Выполнение определения
1. Бюретку заполняют раствором хлороводородной кислоты.
2. В колбу для титрования помещают аликвоту (10,00 мл) раствора NaOH, 2 - 3 капли раствора метилового оранжевого. Колбу с раствором NaOH помещают под бюретку на лист белой бумаги и приливают из бюретки раствор HCl, непрерывно перемешивая плавными круговыми движениями содержимое колбы.
Титрование заканчивают, когда от одной капли раствора кислоты первоначально желтая окраска титруемого раствора становится розово-красной. Титрование проводят не менее 3 раз. Фиксируют объем по бюретке. Для расчета концентрации NaOH используют среднее из 3-х значений объема раствора титранта.
Расчет концентрации NaOH
C. (HCl) . V (HCl)
С(NaOH) = -------------------------------
V (NaOH)
III. Определение содержания серной кислоты
Определение основано на титровании стандартным раствором гидроксида натрия раствора серной кислоты неизвестной концентрации в присутствии метилового оранжевого. При этом протекает реакция:
2NaOH + H 2 SO 4 = Na 2SO 4 + 2H2O.
Масса эквивалента равна 1/2М (H2 SO4) = 98,07/2 = 49,035 г.
Реагенты:
NaOH 0,1000 М раствор;
Контрольная задача с H2 SO4;
Индикатор метиловый оранжевый.
Выполнение определения
1. Получают у преподавателя задачу, содержащую серную кислоту (контрольный раствор), в мерной колбе вместимостью 100,0 мл
2. Разбавляют контрольный раствор до метки дистиллированной водой и тщательно перемешивают.
3. Бюретку заполняют раствором щелочи с точно известной концентрацией.
4. В колбу для титрования помещают аликвоту (10,00 мл) контрольного раствора, 2 - 3 капли раствора метилового оранжевого. Титрование заканчивают, когда от одной капли раствора щелочи первоначально розовая окраска титруемого раствора становится желтой. Фиксируют объем по бюретке. Выполняют не менее 3-х параллельных титрований.
5. Расчет результатов определений
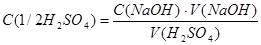

m (H2SО4) = T(H2SО4).Vм.к.
6. Проводят статистическую обработку результатов анализа.

 (1)
(1)
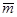 - среднее значение массы серной кислоты;
- среднее значение массы серной кислоты;
 - ошибка взятия навески тетрабората натрия на аналитических весах; Sg составляет 3×10-4г;
- ошибка взятия навески тетрабората натрия на аналитических весах; Sg составляет 3×10-4г;
 - ошибка калибрования мерных колб (из табл. 1, приложения);
- ошибка калибрования мерных колб (из табл. 1, приложения);
 - ошибка калибрования пипетки (из табл. 1);
- ошибка калибрования пипетки (из табл. 1);
 - ошибка определения по бюретке, при титровании тетрабората натрия хлороводородной кислотой (рассчитывают, пользуясь табл. 2);
- ошибка определения по бюретке, при титровании тетрабората натрия хлороводородной кислотой (рассчитывают, пользуясь табл. 2);
 - ошибка определения по бюретке при титровании гидроксида натрия хлороводородной кислотой;
- ошибка определения по бюретке при титровании гидроксида натрия хлороводородной кислотой;
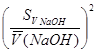 - ошибка определения по бюретке при титровании гидроксида натрия серной кислотой.
- ошибка определения по бюретке при титровании гидроксида натрия серной кислотой.
Коэффициенты (2 и 3) показывают, сколько раз использовались колбы или пипетки в процессе титрования.

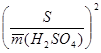 - где
- где 
Рассчитав  , находят Sm, а затем e, например,
, находят Sm, а затем e, например,
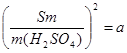 ;
; 
 ;
;

конечный результат массы серной кислоты записывают с учетом доверительного интервала.
Например: если 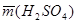 = 0,2234 г, а e = 0,002 г, результат записывают в следующем виде (0223±0,002) г.
= 0,2234 г, а e = 0,002 г, результат записывают в следующем виде (0223±0,002) г.
Суммирование ошибок:
1) ошибка стандартизации тетрабората натрия

2) ошибка стандартизации хлороводородной кислоты (приготовлена в колбе на 200 мл)
 ,
,
где V  = Vaл. = 10 мл;
= Vaл. = 10 мл;
 (HCl) – средний объем HCl, пошедшей на титрование тетрабората натрия по бюретке.
(HCl) – средний объем HCl, пошедшей на титрование тетрабората натрия по бюретке.
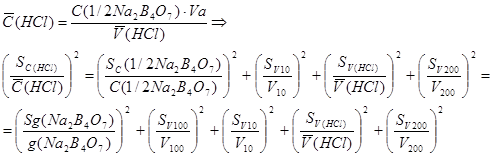
3) ошибка стандартизации гидроксида натрия (NaOH приготовлен в колбе на 250 мл)
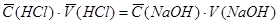

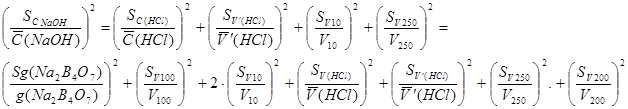
4) ошибка определения серной кислоты
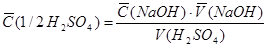

m (H2SО4) = T(H2SО4).Vм.к.

КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Комплексоны – это аминополикарбоновые кислоты. Например, нитрилотриуксусная кислота:
 CH2-COOH
CH2-COOH

 HOOC-CH2-+NН CH2-COOH,
HOOC-CH2-+NН CH2-COOH,
Этилендиаминтетрауксусная кислота (ЭДТУ):

 HOOC-CH2 CH2-COOH
HOOC-CH2 CH2-COOH

 НN+- CH2-CH2-+NН
НN+- CH2-CH2-+NН
 HOOC-CH2 CH2-COOH
HOOC-CH2 CH2-COOH
Молекула ЭДТА содержит четыре способных к диссоциации атома водорода. В растворах имеют место следующие равновесия:
H4Y = H3Y- +H+;
H3Y- = H2Y2- +H+;
H2Y2- = HY3- +H+;
HY3- = Y4- +H+;
В сравнительно кислых растворах (рН < 2) две отрицательно заряженные карбоксильные группы протонируются с образованием кислот-катионов H5Y+ и H6Y2+
H6Y2+ = H5Y+ +H+;
H5Y+ = H4Y +H+;
В обычных комплексонометрических титрованиях формы H5Y+ и H6Y2+ практически не присутствуют.
ЭДТУ быстро и стехиометрично реагирует с ионами металлов, однако она малорастворима в воде и поэтому применяют ее двунатриевую соль – этилендиаминтетраацетат натрия (ЭДТА, комплексон III или трилон Б, сокращенно Na2H2Y).
При титровании ЭДТА солей металлов-комплексообразователей в заключительной стадии определения протекают следующие реакции:
Na2H2Y = 2 Na+ + H2Y2-
Me2+ + H2Y2- = MeY2-+ 2H+
Me3+ + H2Y2- = MeY-+ 2H+
Ионы металлов, независимо от заряда, реагируют с ЭДТА в соотношении 1:1.
|
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 1772; Нарушение авторских прав?; Мы поможем в написании вашей работы!