
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Правило фаз для многокомпонентной системы
|
|
|
|
Уравнение Клапейрона — Клаузиуса
— термодинамическое уравнение, относящееся к квазистатическим (равновесным) процессам перехода вещества из одной фазы в другую (испарение, плавление, сублимация, полиморфное превращение и др.). Согласно уравнению, теплота фазового перехода (например, теплота испарения, теплота плавления) при квазистатическом процессе определяется выражением
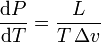
где L — удельная теплота фазового перехода, Δv — изменение удельного объёма тела при фазовом переходе.
Вывод уравнения:
 из общего условия равновесия фаз Гиббса.
из общего условия равновесия фаз Гиббса.
Dμ1= -S1dT+V1dp, тогда -S1dT+V1dp = -S2dT+V2dp
 ,
, 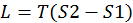 =>
=> 
ПРАВИЛО фаз, закон, связывающий число фаз, находящихся в термодинамически равновесной системе, с числом компонентов системы, числом ее степеней свободы и числом внеш. параметров, определяющих состояние системы.
 N(число компонетов)=2(H2O и NH3), К(количество фаз)=2 (жидкость и пар)
N(число компонетов)=2(H2O и NH3), К(количество фаз)=2 (жидкость и пар)
gn NH3= gж NH3; gn H2O =gж H2O
Компоненты- химически однородная часть системы(вода,спирт)
Фаза – физически однородная часть системы (пар,жидк), отделенную от др. частей (фаз) пов-стями раздела.
Числом компонентов k системы наз. наименьшее число исходных в-в, достаточное для образования всех фаз данной системы.
Под числом степеней свободы, или вариантностью f системы понимается число параметров состояния, таких, как давление, т-ра, концентрации в-в, к-рые можно изменять в нек-ром интервале независимо друг от друга без изменения числа фаз N.
Внеш. параметры, определяющие состояние системы и имеющие одно и то же значение для всех фаз системы, наз. факторами равновесия. Обычно учитывается влияние на систему только двух внеш. параметров - температуры и давления.
Для первого компонента: 
Количество уравнений: (K-1)*N
gn=x1 gn1+x2 gn2+..+xN gnN, где х-доля вещества
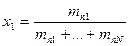
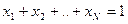
(N-1) – количество независимых переменных для пара(т.е. для одной фазы)
(N-1)*К – количество переменных для каждой фазы (Р и Т)
(N-1)*К+2 – количество переменных для описания всей системы (где 2 – Р и Т)
Правило фаз Гиббса: f=(N-1)*K+2-N(K-1)=N+2-K – количество независимых переменных для описания всей системы.
Правило фаз Гиббса: число термодинамических степеней свободы, или вариантность равновесной термодинамической системы f, определяется как разность числа независимых компонентов системы К и числа сосуществующих фаз N плюс число внешних факторов n, влияющих на равновесие.
|
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 802; Нарушение авторских прав?; Мы поможем в написании вашей работы!