
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кількість речовини
|
|
|
|
3.1. Позначення у системі SІ:
1) відносна атомна маса елемента Аr (Е), наприклад, заліза Аr (Fe)
(r – лат. relatio –відношення);
2) відносна молекулярна маса речовини, наприклад, Карбон (IV) оксиду Mr (CO2);
3) Об’єм газу, наприклад, кисню V(О2);
4) Молярний об’єм VIII [м3/моль] (Vμ), (VM) у системі SІ.
3.2. Кількість речовини – це фізична величина, яка визначається числом структурних елементів. Кількість речовини не є синонімом маси. Одиницею кількости речовини є моль і його похідні кіломоль [кмоль], мілімоль [ммоль], мікромоль [мкмоль] тощо.
3.3 Моль – міра кількости речовини. Моль – кількість простої або складної речовини, яка містить таку кількість структурних елементів (атомів, молекул, йонів або електронів), яка дорівнює кількости атомів у 12г ізотопу вуглецю 12С, а саме
 *тера від гр. “teras” – чудовисько
*тера від гр. “teras” – чудовисько
NA=6,022045(31)·1023 з відносною похибкою 5,1477·10-6 (за новітніми даними NA= 6,0220978·1023) [моль-1].
Тому говорять про молі атомів, молі молекул, молі йонів, молі електронів, тощо. Наприклад, 1моль – це 6,022045·1023 атомів Сульфуру або така ж кількість молекул етилового спирту або стільки ж йонів Купруму (ІІ), або 6,022045·1023 електронів і таке інше.
А 0,6022045·1023 структурних одиниць – це вже 0,1 моль тих же атомів, молекул, йонів, електронів тощо. Можна говорити про кількість молей елементів в 1 молі сполуки, наприклад, 1 моль Кальцій хлориду СаСl2 містить 1 моль Кальцій – йонів (6,022045·1023 окремих йонів) і 2 моля Хлорид – йонів (12,04409·1023 окремих атомів).
Подібно цьому, 1 моль Натрій нітрату NaNO3 містить 1 моль Натрій – йонів (6,022045·1023 атомів), 1 моль атомів Нітрогену (6,022045·1023 атомів) і 3 моля атомів Оксигену (18,066135·1023 атомів).
3.4. Молярна маса (М або μ) – відношення маси до кількости речовини. Її розмірність в системі SІ: [кг/моль], [кг/кмоль], [г/моль], [мг/моль] тощо. Наприклад, молярна маса Карбон (ІV) оксиду CO2 дорівнює 44 [г/моль] (а не 44г); молярна маса сульфатної кислоти H2SO4, дорівнює 98 [г/моль] (а не 98г).
Для реакції згоряння етилового спирту:
С2Н5ОН + 3О2 = 2СО2 + 3Н2О
правдиво, що з 1 моля етилового спирту і 3 молів кисню утворюється 2 моля СО2 і 3 моля Н2О і що з 46 г/моль С2Н5ОН утворюється 2 · 44 = =88 г/моль СО2 та 3·18 = 54 г/моль Н2О.
4. Абсолютна температура Т [К]
4.1. Температура як параметр стану.
Температура є величина, яка характеризує потенціал (рушійну силу) в процесах термічної взаємодії між робочим тілом і зовнішнім середовищем.
4.2. Температура – міра інтенсивности теплового руху молекул, атомів, йонів, електронів; міра нагрітости тіла у стані рівноваги; міра середньої кінетичної енергії поступального руху молекул для одноатомних ґазів, близьких до властивостей ідеального ґазу у стані рівноваги.
 4.3. Внесення в систему SІ додаткової одиниці – абсолютної температури – привело до появи величини незвичної розмірности – константи Больцмана k [Дж/К]. Але обидві величини (Дж і К) в точному (строгому) смислі мають однакову розмірність – розмірність енергії [Дж].
4.3. Внесення в систему SІ додаткової одиниці – абсолютної температури – привело до появи величини незвичної розмірности – константи Больцмана k [Дж/К]. Але обидві величини (Дж і К) в точному (строгому) смислі мають однакову розмірність – розмірність енергії [Дж].
Тому в системі одиниць, в якій основними одиницями вважають три величини – довжину, час і масу, стала Больцмана повинна рахуватися безрозмірною (подібно тому, як безрозмірним є коефіцієнт переведення морських миль у метри).
 Енергія і температура відрізняються на k.
Енергія і температура відрізняються на k.
Майєр і Джоуль відкрили зв’язок між теплом і енергією, а ще раніше Карно зрозумів, як відбувається перетворення тепла в роботу.
Після цього прийшов час зрозуміти, що є температура. Температура виявилася схожою на енергію: додаємо тепла – зростає температура тіла; тіло звершує роботу – його температура падає.
4.4. Так як реальні процеси, системи не є рівноваговими, то температура є характеристикою цих систем умовною, приблизною.
Тому розрізняють температури, які визначають за:
1) розподілом частинок системи за рівнем енергії (розподіл Больцмана) – ТБ – температура збудження;
2) розподілом частинок за швидкостями руху (розподіл Максвела) – кінетична температура ТМ, яка характеризує рівноваговий стан і є мірою кінетичної енергії поступального руху молекул:
 Екін. =
Екін. = 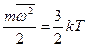 , (2.3)
, (2.3)
де 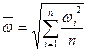 - середня квадратична швидкість молекул;
- середня квадратична швидкість молекул;
m – маса молекул;
 k – константа Больцмана;
k – константа Больцмана;
 kT – фактор Больцмана.
kT – фактор Больцмана.
3) розподілом частинок за ступенем іонізації речовини (формула Саха) – Тс – іонізаційна температура.
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 1068; Нарушение авторских прав?; Мы поможем в написании вашей работы!