
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа рівноваги і способи вираження складу реакційної суміші
|
|
|
|
КОНСТАНТА РІВНОВАГИ І СТАНДАРТНИЙ ПОТЕНЦІАЛ ҐІББСА ХЕМІЧНОЇ РЕАКЦІЇ
1. Для розрахунку стандартного потенціалу Ґіббса хемічної реакції за стандартними потенціалами утворення вихідних і кінцевих речовин користуються правилом, аналогічним правилу для розрахунку теплових ефектів хемічної реакції за теплотами утворення.
Так, для реакції
aA+bB↔ l L+eE
її стандартний потенціал Ґіббса дорівнює
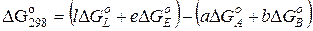 , (9.73)
, (9.73)
або у загальній формі для довільної реакції
 , (9.74)
, (9.74)
де 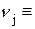 l, e, …;
l, e, …; 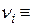 a, b, … – стехіометричні коефіцієнти кінцевих і вихідних компонентів;
a, b, … – стехіометричні коефіцієнти кінцевих і вихідних компонентів;
 ,
, 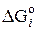 – стандартні потенціали Ґіббса утворення кінцевих L, E і вихідних A, B компонентів з простих речовин.
– стандартні потенціали Ґіббса утворення кінцевих L, E і вихідних A, B компонентів з простих речовин.
2. Розрахунок стандартної константи рівноваги:
· для реакції у суміші ідеальних ґазів:
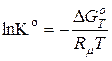 ; (9.75)
; (9.75)
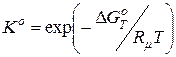 ; (9.76)
; (9.76)
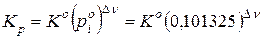 [МПа]; (9.77)
[МПа]; (9.77)
· для реакції у суміші реальних ґазів:
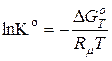 ; (9.78)
; (9.78)
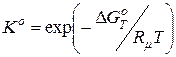 ; (9.79)
; (9.79)
 [Мпа∆ν].(9.80)
[Мпа∆ν].(9.80)
1. На підставі рівняння Карно-Клапейрона у вигляді
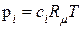 , (9.81)
, (9.81)
де
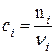
і закону Дальтона для ідеальної ґазової суміші вигляді
 (9.82)
(9.82)
знаходимо співвідношення між парціальним тиском р і, молярною концентрацією с і і молярною часткою хі і-го компоненту:
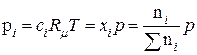 , (9.83)
, (9.83)
де n i – число молей і-го компоненту;
p – загальний тиск;
р і – парціальний тиск і-го компоненту;
 – загальне число молей всіх компонентів.
– загальне число молей всіх компонентів.
Підставляючи (9.83) у рівняння (9.84)
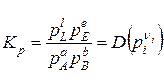 , (9.84)
, (9.84)
отримуємо:
 , (9.85)
, (9.85)
де ∆ν= l +e–a–b.
Константа К х для реакції у ґазовій фазі (на відміну від Кр і Кс) залежить від загального тису р.
Якщо реакція в ґазовій фазі протікає без зміни числа молей, то з (9.85) випливає:
∆ν=0: Кр=Кс=К х.
2. Для рівноваги хемічної реакції в ідеальному розчині константа рівноваги
 ; (9.86)
; (9.86)
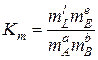 ; (9.87)
; (9.87)
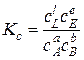 , (9.88)
, (9.88)
де 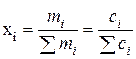 ; (9.89)
; (9.89)
x i – молярна частка компонентів;
m i – моляльність;
c i –молярність;
 ;
;
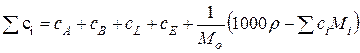 ;
;
М і – молекулярні маси реаґентів;
Мо – молекулярна маса розчинника;
ρ – густина розчину.
Звідки константи рівноваги в ідеальному розчині:
 . (9.90)
. (9.90)
3. Константи рівноваги в суміші реальних ґазів пов’язані співвідношенням:
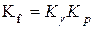 . (9.91)
. (9.91)
У суміші реальних ґазів Кр залежить від загального тиску ґазу, так як
 , причому
, причому 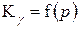 .
.
4. Константи рівноваги в неідеальних розчинах пов’язані співвідношенням:
 , (9.92)
, (9.92)
де 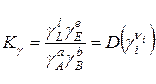 . (9.93)
. (9.93)
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 939; Нарушение авторских прав?; Мы поможем в написании вашей работы!