
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гетерогенна хемічна рівновага
|
|
|
|
1. Гетерогенними називають реакції, при яких компоненти системи знаходяться у різних фазах. Наприклад:
FeO(т)+CO(г)=Fe(т)+CO2(г). (9.101)
Гетерогенна реакція в загальному вигляді:
 ,(9.102)
,(9.102)
де  – ґазові компоненти;
– ґазові компоненти;
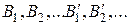 – компоненти конденсованих фаз [(р), (т)].
– компоненти конденсованих фаз [(р), (т)].
2. Так як у стані рівноваги  , то для (9.102)
, то для (9.102)
 , (9.103)
, (9.103)
де  – для ґазової фази;
– для ґазової фази;
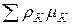 – для конденсованої фази.
– для конденсованої фази.
3. Нехай ґазова суміш – реальний ґаз, а конденсована фаза – тверді і рідкі розчини.
Підставимо
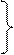

|
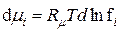 ,
,
 ;
;


|
 ,
,
 ; (9.104)
; (9.104)
у (9.103):
 , (9.105)
, (9.105)
або
 . (9.106)
. (9.106)
Звідки
 , (9.107)
, (9.107)
де  – фуґітивности компонентів у ґазових фазах;
– фуґітивности компонентів у ґазових фазах;
 – активності компонентів у конденсованих фазах.
– активності компонентів у конденсованих фазах.
4. Деякі узагальнення:
· рівняння (9.107) є узагальнений вираз закону діяння мас;
· якщо конденсовані фази є чисті речовини, та їх а =const при даній Т і їх приймають ≈1, тоді вираз (9.107) набуде вигляду:
 ; (9.108)
; (9.108)
· якщо гази ґазової фази підпорядковані законам ідеальних ґазів, то в (9.107) парціальні фуґітивности можна замінити парціальними тисками: 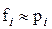 ;
;
· якщо конденсовані фази – ідеальні розчини, то в (9.107) активности можна замінити концентраціями (молярними частками, …).
5. Приклади рівнянь для констант рівноваги:
Приклад 1. С(т)+СО2(г)=2СО(г), вважаючи ґазову фазу сумішшю ідеальних ґазів; активність чистого вуглецю приймаємо сталою а (с)≈1:
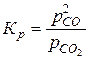 . (9.109)
. (9.109)
Приклад 2. FeO(р)+H2(г)=Fe(р)+H2O(г), вважаючи ґазову фазу сумішшю ідеальних ґазів; FeO погано розчинний в Fe; активність а (Fe)=1:
 , (9.110)
, (9.110)
де  – коефіцієнт активности оксиду феруму (ІІ) в Fe;
– коефіцієнт активности оксиду феруму (ІІ) в Fe;
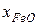 – молярна частка оксиду феруму (ІІ) в Fe(р).
– молярна частка оксиду феруму (ІІ) в Fe(р).
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 447; Нарушение авторских прав?; Мы поможем в написании вашей работы!