
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Современная теория зародышеобразования в адсорбированной фазе при физическом осаждении паров. 2 страница
|
|
|
|
Среди химических методов осаждения в последнее время довольно широко развиваются методы распылительного пиролиза, или химического осаждения с использованием прямой инжекции жидкого прекурсора или его раствора непосредственно на подложку - Direct liquid injection (DLI) CVD или распыления на разогретые подложки аэрозолей - Aerosol Assisted (AA) CVD, которые могут создаваться из растворов, в частности,, в воде термически разлагающихся солей соответствующих компонентов сложных или простых оксидов различными способами, например, под действием ультразвука. Во втором случае только часть исходных компонентов будет подвергаться пиролизу после достижения частицей аэрозоля температуры подложки, В силу разной летучести и устойчивости к нагреванию компоненты могут улетучиваться с различной скоростью или разлагаться ещё на подлете к подложке и оседать уже в виде твердых частиц и агломератов. Такие явление могут приводить к снижению химической и фазовой гомогенности пленок, что требует корректировки состав исходных растворов, повышая в них долю летучих компонентов. Введение в рабочие растворы растворимых в данном растворителе (например, воде) полимеров позволяет снизить отрицательное влияние указанных факторов, т.к. температуры разложения солей нивелируются.
К химическим методам осаждения относят также нанесение тонких полимерных слоев или покрытий, в частности поли-пара-ксилилена, фторорганических и других полимеров полимеризацией мономеров в газовой фазе (см. курс «Химия полимеров).
На практике часто используется гибридное физико-химическое осаждение из газовой фазы - Hybrid Physical-Chemical Vapor Deposition (HPCVD)) — процесс, сочетающий и химические превращения прекурсоров, и испарение твёрдого материала.
Химическое осаждение из газовой фазы чаще всего используется для нанесения неорганических (неметаллических и металлических) слоев и покрытий. Исходными реагентами при этом служат неорганические и элемент- (чаще всего кремний-) или металл-органические газообразные соединения, взаимодействующие с другими составляющими смесей (водородом, азотом, аммиаком, окисью углерода и т.п.) по сложным схемам, сочетающим реакции разложения или пиролиза, восстановления и/или окисления. Например, в технологии производства МЭМС методами поверхностных микрообработок используются следующие схемы реакций химического осаждения:
· поликристаллического кремния: SiH3Cl → Si + H2 + HCl; SiH4 → Si + 2 H2
· диоксида кремния: SiH4 + O2 → SiO2 + 2 H2; SiCl2H2 + 2 N2O → SiO2 + 2 N2 + 2 HCl; Si(OC2H5)4 → SiO2 + побочные продукты
· нитрида кремния: 3 SiH4 + 4 NH3 → Si3N4 + 12 H2; 3 SiCl2H2 + 4 NH3 → Si3N4 + 6 HCl + 6 H2
· гидрированного нитрида кремния: 2 SiH4 + N2 → 2 SiNH + 3 H2; SiH4 + NH3 → SiNH + 3 H2
· вольфрама: WF6 → W + 3 F2; WF6 + 3 H2 → W + 6 HF
· Mo, Ta и Ti: 2 MCl5 + 5 H2 → 2 M + 10 HCl
· нитрида титана: TiCl4 + N2 + 2H2 ® TiN + 4HCl
· арсенида галлия: 6GaAs+6HCI «As4+GaCl+3H2
· графита: СН4→ графит.
Очевидно, что механизм, кинетика и глубина прохождения этих реакций оказывают значительное влияние на механизм и кинетику элементарных физических процессов формирования тонких слоев или покрытий и, соответственно, на их структуру и свойства, резко усложняя и затрудняя их теоретическое описание.
Специфическим методом химического осаждения (CVD) является метод химических транспортных реакций (ХТР), с помощью которого получают тонкие слои и покрытия вольфрама, молибдена, ниобия и других тугоплавких металлов, которые получить другими методами невозможно или очень трудно. Данные металлы имеют ОЦК решетку, высокую энергию межатомных связей и, как следствие, обладают высокой твердостью, прочностью, температурой плавления, хорошо проводят тепло и электрический ток.
Суть метода ХТР заключается в следующем. В качестве исходного материала используются легколетучие химические соединения, например, галогениды металлов. Эти соединения испаряются, переносятся через газовую фазу, осаждаются на поверхности с последующим восстановлением или же разложением при температуре значительно ниже температуры плавления металла (при 100…700 0С). В результате на поверхности выделяется твердое веществ (металл), которое и образует покрытие. Схема процесса представлена на рис. 2.15. Например, процесс нанесения покрытий вольфрама путем восстановления водородом гексафторида вольфрама протекает в соответствии с реакцией: WF6 + 3H2 ® W↓ + 6HF↑.
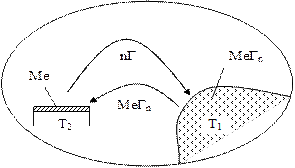
Рис. 2.15. Схема осаждения покрытия методом ХТР в замкнутом реакторе
При температуре Т1 происходит испарение летучих химических соединений MeГn. Подложка, на которую наносится покрытие, имеет температуру Т2. Образование твердого осадка (покрытия) происходит в результате протекания одной из следующих основных реакций.
1. Реакция диспропорционирования, т. е. реакция смены валентности металла (с n на m):
n/mМеГn (пар) ®(n/m-1) Ме (тв. сост.) ¯+ МеГm (газ) . Здесь Ме – металл; Г–галоген.
2. Реакция термической диссоциации:
МеГn (пар) ® Ме (тв.)¯ + nГ(газ).
3. Реакция восстановления соединений металла водородом:
МеГn (газ) + n/2H2 ® Me(тв.)¯ + nHГ(газ) .
Иногда используют одновременно протекающие реакции, например, диссоциации и восстановления. В результате использования таких процессов удается значительно снизить температурный режим осаждения покрытия по сравнению с другими методами формирования, например, методом резистивного испарения.
С физико-химической точки зрения основные процессы, протекающие при реализации метода ХТР, такие же, как и при получении покрытий методом испарения.
В формировании покрытий методом ХТР можно выделить следующие основные стадии:
1. Подготовка технологического вещества (перевод его в газовую фазу, очистка и т.д.).
2. Подача газообразных, реагирующих компонентов к поверхности.
3. Адсорбция газообразных соединений.
4. Протекание реакций на поверхности.
5. Десорбция газообразных продуктов реакции.
В последнее время нанесение покрытий методом ХТР осуществляется преимущественно в прямоточных реакторах, в которых размещают нагретую до температуры Т2 подложку и к ее поверхности подают пары химических соединений и газ-носитель (рис. 2.16).

Рисунок 2.16. Схема осаждения покрытия методом ХТР в прямоточном реакторе
При данной схеме осаждения происходит непрерывное удаление продуктов реакции из зона осаждения, что способствует повышению качества формирующегося покрытия.
В общем случае толщина покрытия, скорость его роста зависят от значения температуры Т2, общего давления в системе и парциального давления химических соединений, скорости продува реактора.
Характер и направление химических реакций определяются изменением свободной энергии Гиббса. Повышение температуры реакции эндотермических реакций приводит к увеличению константы равновесия и, соответственно, к увеличению выхода продуктов реакции.
Реакции осаждения покрытия могут протекать как в кинетическом, так и в диффузионном режимах. При реализации кинетического режима выход продукта определяется скоростью протекания химических процессов, зависит от энергии активации соответствующей химической реакции. При диффузионном режиме скорость реакции определяется скоростью подвода реагирующих компонентов.
При низких температурах Т2 реакция выделения металла на поверхности детали протекает преимущественно в кинетическом режиме (концентрация исходных компонент существенно не влияет на скорость роста покрытия), и образующиеся слои имеют мелкозернистую структуру. При повышении температуры скорость реакции возрастает и, соответственно, возрастает скорость роста покрытия; при этом образуются слои с крупнозернистой структурой (реализуется диффузионный режим: скорость роста пленки сильно зависит от скорости подачи газообразных продуктов к поверхности подложки и десорбции продуктов реакции с подложки). Дальнейшее повышение температуры приводит к тому, что реакция выделения металла протекает не только на поверхности подложки (детали), но и в объеме, т. е. осуществляется гомогенный режим химической реакции. В этом случае уменьшается скорость роста покрытия, наблюдаются нежелательные потери металла. Таким образом, температура поверхности оказывает экстремальное влияние на скорость роста покрытий, определяет их структурное состояние.
К числу основных параметров, влияющих на скорость роста покрытия, следует отнести скорость подачи продуктов реакции. При повышении скорости подачи у поверхности подложки повышается давление паров, что вызывает увеличение плотности зародышей. В свою очередь это определяет образование сплошного слоя при его меньшей эффективной толщине. При этом формируются покрытия с более дисперсной структурой.
Существенное влияние на структуру и скорость роста покрытий оказывают адсорбированные на подложке газовые слои, которые изменяют значение энергии адсорбции, условия зародышеобразования и диффузию выделяющихся атомов металла. В ряде случаев наблюдается химическое взаимодействие атомов металла с атомами адсорбированных слоев.
Свойства и структура покрытий зависят и от их толщины. Как правило, в слоях, непосредственно прилегающих к поверхности подложки, наблюдается образование и рост ориентированных структур, в процессе роста покрытия ориентация кристаллических образований становится менее выраженной.
Очень важной проблемой при нанесении покрытий методом ХТР является обеспечение необходимой прочности адгезионного соединения. С целью ее повышения, снижения внутренних механических напряжений при осаждении покрытий методом ХТР используют следующие технологические приемы.
1. Проводят тщательную многостадийную предварительную подготовку поверхности. На первом этапе осуществляют механическую очистку поверхности. Затем с целью удаления оксидных слоев проводят химическое и электрохимическое травление. В ряде случаев высокая адгезия достигается при применении ионной обработки, УЗ-очистки и других методов поверхностной обработки. Наиболее эффективным методом удаления оксидов и гидрооксидов является восстановление металлов в результате прогрева подложки в среде сухого водорода.
2. Формируют промежуточные адгезионно-активные слои. Промежуточные слои имеют отличную от материала основы природу и могут быть образованы в результате сегрегации (диффузии отдельных компонент сплава из объема на поверхность при нагреве или ионной обработке).
4. Осуществляют термообработку покрытия. При нагреве интенсифицируются диффузионные процессы, в итоге образуются переходные слои, которые способствуют повышению адгезионной прочности. При этом надо учитывать, что при определенных условиях возможно образование хрупкой интерметаллической фазы. С целью предотвращения образования этой фазы на поверхность детали наносят антидиффузионный промежуточный слой толщиной 1…5 мкм, например, из оксидов, силицидов тугоплавких металлов.
В технологических процессах получения тонких слоев и покрытий методами химического осаждения паров часто используется плазменное стимулирование процессов. При этом используется, как правило, низкоэнергетичная (низкоэнтальпийная) плазма, которая характеризуется относительно невысокой температурой и низкой степенью ионизации. Плазма содержит свободные электроны, ионы, нейтроны, частицы, которые находятся в состоянии непрерывного движения, сталкиваются между собой, что приводит в общем случае к генерации или рекомбинации реакционно-способных частиц. Наиболее широко используется плазма тлеющего разряда, которая явлется неизотермической: температуры электронов и ионов неодинаковы, поэтому для ее поддержания нужен постоянный внешний подвод энергии.
В общем случае все элементарные процессы, протекающие в плазме, в зависимости от состояния взаимодействующих частиц можно разделить:
- на элементарные процессы, протекающие с участием только нейтральных атомов. К их числу относят, например, диссоциацию химических соединений: АВ→ А+В. При их протекании зарядка этих частиц не наблюдается. В данную группу входят также обменные процессы, протекающие по схеме АВ+С→АС+В;
- на процессы с участием возбужденных или электрически заряженных частиц. В эту группу включают следующие основные элементарные акты:
· возбуждение частиц;
· ионизация атомов и молекул;
· рекомбинация заряженных и возбужденных частиц;
· диффузия.
Основной механизм данных процессов заключается в изменении состояния частиц в результате их столкновения. В общем случае различают столкновения упругие и неупругие. Неупругие, в свою очередь, разделяют на неупругие столкновения первого и второго рода. Столкновения называют упругими, если при протекании выполняются законы сохранения импульса и кинетической энергии. При этом происходит изменение кинетической энергии частиц, которое для бинарных процессов определяется выражением:  . Из данного соотношения следует, что при m1<<m2
. Из данного соотношения следует, что при m1<<m2 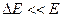 . Данный вывод справедлив при оценке особенностей упругих столкновений электронов с атомами или ионами. В таких системах упругие столкновения не оказывают существенного влияния на процессы передачи энергии.
. Данный вывод справедлив при оценке особенностей упругих столкновений электронов с атомами или ионами. В таких системах упругие столкновения не оказывают существенного влияния на процессы передачи энергии.
При неупругом столкновении происходит изменение внутренней энергии атомов. В этом случае  . Такого рода процессы получили название неупругих столкновений первого рода.
. Такого рода процессы получили название неупругих столкновений первого рода.
Неупругие столкновения второго рода – столкновения, которые протекают между электронами и возбужденными атомами, при которых электрон получает энергию за счет изменения внутренней энергии атомов.
Отметим, что внешние электрические и магнитные поля поляризуют плазму, увеличивая при этом вероятность актов столкновения.
Наиболее часто в плазме протекают процессы возбуждения атомов. Возбужденные атомы образуются, когда в результате столкновения электрон получает дополнительную энергию, и переходят на уровни с более высокой энергией. Возбуждение наблюдается в течение очень короткого промежутка времени (~10-8с). По истечении этого промежутка времени атом возвращается в основное состояние, испуская при этом квант энергии.
Процесс возбуждения наблюдается при взаимодействии атома с ионом: А+В+→А*+В+. При протекании таких реакций ион В+ передаёт часть своей энергии атому А.
Атомы могут переходить в возбужденное состояние и в результате его взаимодействия с электроном (электроностимулированное возбуждение, в том числе эффект электронного циклотронного резонанса (ЭЦР): А+е→А*+е. Причиной возбуждения атомов может быть и поглощение им электромагнитного излучения. Такой процесс называют фотовозбуждением. Он протекает по схеме А+hν→А*.
К числу наиболее вероятных механизмов возбуждения относят и взаимодействие атомов друг с другом, в результате которого атом В передает часть своей энергии атому А: А+В→А*+В. Если частота взаимодействий достаточно велика, то могут проходить процессы ступенчатого возбуждения, когда электрон последовательно переходит с одного энергетического возбужденного уровня на другие, более высокие.
Процесс возбуждения характеризуется следующими основными параметрами:
· эффективное сечение взаимодействия σвз;
· вероятность взаимодействия Рвз;
· длина свободного пробега λ;
· энергия возбуждения.
При высокой плотности заряженных частиц и большом числе столкновений атомов, ионов, электронов не исключена возможность одновременного перехода в возбужденное состояние нескольких электронов. При этом полная энергия возбуждения электронов может быть выше энергии ионизации атомов. В этом случае возможен переход электронов в основное состояние с излучением электромагнитных квантов. На основной уровень возвращается один из электронов, а второй получает дополнительную энергию и покидает атом. В результате образуется ион. Такой процесс носит название автоионизации.
В общем случае ионизация атомов является логическим продолжением процесса возбуждения. Процесс, как правило, протекает по схеме А→ А*→А++е, А+е→А-. Вероятность ионизации очень сильно зависит от энергии частиц, участвующих в процессе столкновения. В общем случае, эта зависимость имеет экстремальный характер. Как правило, наиболее эффективная ионизация имеет место при энергии электронов 20-100 эВ.
Процесс ионизация может происходить по различным механизмам:
1) в течение одного акта взаимодействия. В этом случае энергия, полученная атомом, должна быть больше (или равна) энергии ионизации 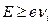 , где
, где  – потенциал ионизации атома;
– потенциал ионизации атома;
2) в результате ступенчатого возбуждения, последовательных переходов электронов на более высокие энергетические уровни. Частным случаем данного процесса является автоионизация.
Ступенчатое возбуждение имеет место, если частота столкновений, актов энергетического воздействия очень велика. Тогда электрон не успевает перейти на основной уровень, последовательно возбуждается и, в итоге, получает энергию, достаточную для ионизации атома.
Часто, при высокой плотности энергетического воздействия, процессы ионизации сопровождаются диссоциацией атомов. Такие процессы, как правило, протекают по схеме АВ→А++В-,АВ→А++В+е.
Как известно, в газовом разряде, в плазме генерируются интенсивное коротковолновое излучение. Если энергия кванта hν≥еvi (данному условию удовлетворяет электромагнитное излучение ультрафиолетового диапазона), то протекают процессы фотоионизации.
Анализ процессов, протекающих в плазме, показывает, что наиболее вероятна ударная ионизация. Это обстоятельство широко используется для повышения степени ионизации плазмы. Так, например, в плазму вводят атомы, которые легко ионизируются и, в свою очередь, способны вызвать ударную ионизацию других атомов, находящихся в газовой фазе.
Большой вклад в процессы генерации заряженных частиц вносят реакции ассоциативной ионизации. Они протекают в случае, когда энергия, полученная молекулой, мала и её разрушение не происходит: АВ → АВ++е. Достаточно часто происходят процессы диссоциативной ионизации АВ→А++В-, АВ→А++В++2е.
Наряду с процессами ионизации и возбуждения протекают и процессы, им обратные (процессы рекомбинации) А* → А + hν; А+ → А(А*). При рекомбинации сложных молекул возможна их диссоциация АВ++е → А+В.
Основной вклад в снижение степени ионизации вносит ионная рекомбинация, протекающая при столкновении противоположно заряженных частиц и сопровождающаяся снижением внутренней энергии плазмы. Избыток энергии может выделяться по следующим направлениям:
происходит передача энергии третьей частице С: А++В-+С→А+В+С*, А++В-+С→АВ+С*; или наблюдается испускание электромагнитного излучения А++В - → АВ+hν, или имеет место образование возбужденных частиц А++В- → А*+В*.
Вероятность проявления указанных выше процессов зависит от режимов и условий протекания газового разряда. Так, при высокой плотности плазмы (давление в зоне 10 Па и более) наиболее вероятен процесс рекомбинации вследствие передачи энергии третьей частице.
Значительное влияние на зарядовое состояние плазмы оказывают процессы ион-электронной рекомбинации А++е → А(А*)+hν, АВ++е → А*+В*. Генерируемые в плазме возбужденные и заряженные частицы способны взаимодействовать друг с другом и при определенных условиях образовывать химические соединения.
3.Формирование тонких слоев и покрытий из растворов (золь-гелевая технология).
К способам формирования тонких слоев и покрытий из растворовотносятся нанесения полимерных органических слоев и покрытий из растворов полимеров или преполимеров методами центрифугирования, окунания или распыления, которые были рассмотрены в разделе фотолитографии. Для формирование тонких неорганических слоев и покрытий из растворов аналогичными способами широко используется так называемая золь-гелевая технология. Эта технология очень близка к технологии получения органических полимеров по реакциям трехмерной полимеризации, поликонденсации или полиприсоединения полифункциональных мономеров или олигомеров и их смесей, которые подробно рассматриваются в курсах «Химия полимеров» и «Физика полимеров».
К золь-гелевой технологии относят большую группу методов получения (синтеза) неорганических стекловидных оксидных или керамических материалов, иногда рассматриваемых как неорганические полимеры. Наиболее известные варианты золь-гелевой технологии заключаются в контролируемом гидролизе и поликонденсации продуктов гидролиза в водных или водно-спиртовых растворах при заданной температуре и рН среды спиртовых производных (алкоголятов) гидроксидов металлов и переходных элементов, так называемых алкоксидов M(OR)x или хлоридов, реже нитридов этих элементов М(Cl)х и М(NO3)х соответственно, где M - атомы Si, Ti, Zr, V, Zn, Al, Sn, Ge, Mo, W и других элементов с последующим удалением (сушкой) или вытеснением растворителя и термообработкой (обжигом, спеканием) нерастворимых продуктов поликонденсации. Обязательными компонентами при этом являются также растворители (как правило, простые спирты: этанол, пропанол, изопропанол и др.), вода и кислоты (чаще всего минеральные – HCl, HNO3 и др.). Гидролиз и начальные стадии поликонденсации приводят к образованию золя – коллоидной дисперсии сетчатых (микрогелевых) частиц полигидроксидов, размер которых может лежать в пределах 10-1000 нм:

(RO)3 ΞSi – OR + HOH → (RO)3 Ξ Si – OH + ROH, или Ξ Si – OH + RO – Si Ξ →Ξ Si – O – SiΞ +ROH, или
Ξ Si – OH + HO – Si Ξ → ΞSi – O – Si Ξ + HOH.
На более глубоких стадиях поликонденсации образуется неорганический «мокрый» гель – непрерывная пространственная структура из соединенных ионно-ковалентными связями коллоидных частиц (остов геля) с заключенным (иммобилизованным) растворителем, также образующим непрерывную среду:

Согласно современным представлениям формирование геля вблизи критической точки (возникновения непрерывного остова) описывается теорией перколяции или протекания и геометрией фракталов.
Скорость и степень полноты протекания процессов образования золя и «мокрого» геля зависит от ряда химических и технологических факторов: а) природы и количества алкоксисоединения; б) количества воды; в) кислотности (рН) среды; г) природы и количества органических растворителей; д) приемов гомогенизации золь-гелевой системы; е) температуры и длительности процесса синтеза.
Важнейшую роль в золь-гелевой технологии играют процессы удаления растворителя из «мокрого» геля. В зависимости от метода их осуществления, могут быть получены различные продукты (ксерогели, амбигели, криогели, аэрогели), сохраняющие наноразмерные структурные элементов и высокие значения удельной поверхности (сотни м²/г) и служащие промежуточными продуктами (прекурсорами) при получении оксидных пленок, нанопорошков или керамики. Основные процессы и получаемые материалы в золь-гелвой технологии схематически показаны на рис. 2.17.

Рис. 2.17. Основные процессы и получаемые материалы в золь-гелевой технологии: I → превращение золя (1) после гидролиза и конденсации исходных продуктов (созревания) в «мокрый» гель (2); II → сушка геля в суперкритических условиях или промывание его вытесняющим воду растворителем с образованием аэрогеля (3); III → сушка геля в обычных условиях с образованием ксерогеля (4); IV→осаждение частиц золя с образованием нанопорошка (6); V → нанесение золя на подложки и формирование пленки ксерогеля (7); VI → обжиг ксерогеля (4) или пленки ксерогеля (7) и формирование монолитной керамики (5) или покрытия (8).
Формирование геля не останавливается в точке гелеобразования. В мокром геле единый кластер сосуществует с золем, который содержит множество мелких кластеров. В процессе выдержки во времени гель "стареет", в нем протекают процессы структурных изменений - присоединение мелких кластеров к общему остову - непрерывному кластеру. Кроме того, в гелях могут продолжаться реакции конденсации, не прошедшие до конца в золях. В процессе старения гелей обычно происходит усадка гелей, обусловленная деформацией сетки геля и удалением жидкости из пор. Высушенный гель называют ксерогелем. Ксерогель часто уменьшается в объеме в 5-10 раз по сравнению с объемом мокрого геля. Существуют специальные приемы, которые позволяют высушивать мокрый гель без изменения его структуры. Например, суперкритической сушкой при высоком давлении и низкой температуре получают аэрогель – сухой гель, в котором сохранился скелет мокрого геля, а поры взамен удаленной жидкой фазы заполнены воздухом. После высушивания ксерогели и аэрогели подвергают обжигу, в процессе которого формируется монолитный стеклообразный или керамический материал. Во время обжига происходит множество сложных физических и химических процессов, связанных с деструкцией органических фрагментов, встроенных в неорганическую сетку геля, удалением растворителей, летучих продуктов деструкции и химически связанной воды. Происходит перестройка структуры неорганического полимера – идет процесс спекания, а в ряде случаев и кристаллизация.
Наиболее часто в золь-гелевой технологии применяется этиловый эфир ортокремниевой кислоты, или сокращенно тетраэтоксисилан (ТЭОС). В предельном случае, если предположить, что реакция гидролиза ТЭОС идет до конца, ее можно выразить следующим образом: (C2H5O)4Si + 4H2O →H4SiO4 + 4C2H5OH. По мере протекания гидролиза ТЭОС равновесие сильно смещается вправо. Для сдвига равновесия влево и замедления скорости реакции гидролиз ТЭОС обычно осуществляют в присутствии этанола в кислой среде (pH < 7), хотя при этом процессы гидролиза ТЭОС не проходят до конца. Золи на основе ТЭОС, гидролизуемого в кислой среде, могут быть допированы (легированы) алкоксидами или солями металов, что придает получаемым силикатам необходимые свойства – каталитические, электрические и др.
Среди первых объектов, изготавливаемых золь-гелевым методом еще с 60-х гг. прошлого века в микроэлектронике в качестве источников легирующих примесей – допантов, были стекловидные нанотолщинные пленки. В настоящее время в планарной технологии микроэлектроники и микросистемной техники такие пленки используются как маскирующие, изолирующие, планаризирующие, жертвенные и геттерные покрытия, а также в качестве металлоксидных чувствительных элементов различных сенсоров, в том числе, болометров. Наноразмерные пленки толщиной 30-200 нм получают из золей методом центрифугирования, поэтому в зарубежной литературе часто их называют "spin-on glass"-пленками.
Золь-гелевая технология получения стекловидных пленок имеет ряд существенных достоинств, позволяя проводить многие технологические процессы в регулируемых условиях при температуре 250-450 °С. Однако для обеспечения требуемых свойств таких пленок - равномерности по толщине, целостности или сплошности (отсутствия разрывов и трещин), гомогенности по структуре (отсутствия расслоений и кристаллических включений), способности удаляться в селективных травителях или методами «сухого» травления без нарушения нижележащих слоев, не говоря уже об их функциональных свойствах, необходимо разрабатывать оптимальные составы золей, подбирать оптимальные условия нанесения пленок на подложки и оптимальные режимы термообработок. Сделать это при многоэтапности циклов получения наноразмерных пленок из неустойчивых во времени золей (синтез и созревание золей, формирование пленок на подложке, гелеобразование, сушка и отжиг с переходом элементорганических мономеров в неорганические полимеры и оксидные слои) многообразии и сложности протекающих при этом физико-химических процессов, достаточно сложно. Каждый из этих этапов оказывает существенное влияние на свойства формируемых пленок, поэтому добиться воспроизводимости свойств и качества пленок чрезвычайно трудно.
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 746; Нарушение авторских прав?; Мы поможем в написании вашей работы!