
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение подлинности. Количественное определение
|
|
|
|
Количественное определение
Оценка чистоты.
Раствор С1. Растворите 2,5 г ЛС в воде, свободной от диоксида углерода, и разбавьте до 50 мл тем же растворителем.
Раствор С2. Растворите 3 г ЛС в дистиллированной воде. Осторожно добавьте 10 мл азотной кислоты и выпарите до сухого остатка. Растворите остаток в 10 мл дистиллированной воды, нейтрализуйте разведенным раствором натрия гидроокисида и разбавьте до 30 мл дистиллированной водой.
NO2-+ 2H+® 2HNO2® NO2 + NO + H2O
Прозрачность и цветность. Раствор С1 – прозрачный и по окраске не превосходит эталон цветности В6.
Кислотность и щелочность. К 10 мл раствора С1, добавьте 0,05 мл раствора фенолового красного, 0,1 мл 0,01 М раствора натрия гидроксида. Раствор приобретает красную окраску. При добавлении 0,3 мл 0,01 М раствора хлороводородной кислоты окраска раствора изменяется на желтую.
При определении хлоридов, сульфатов и тяжелых металлов используют раствор С2, чтобы избежать образования малорастворимого (1:300) белого осадка серебра нитрита AgNO2: умеренно растворимого (1:67,5) ВаNO2и Pb(NO2
)2
Хлориды. Разбавьте 10 мл раствора С2 до 15 мл дистиллированной водой. Раствор сравните с эталоном на хлориды. Содержание хлоридов не должно превышать 50 ррm.
Cl-+ Ag+® AgCl¯
Сульфаты. Разбавьте 7,5 мл раствора С2 до 15 мл дистиллированной водой. Раствор сравните с эталоном на сульфаты. Содержание сульфатов не должно превышать 200 ррm.
Тяжелые металлы. Разбавьте 10 мл раствора С2 до 20 мл дистиллированной водой. 12 мл полученного раствора сравните с эталоном на тяжелые металлы (1 ррm Pb). Содержание тяжелых металлов не должно превышать 20 ррm.
Потеря в весе при высушивании. Не более чем 1%, при высушивании 1,000 г вещества в вакууме.
Метод обратной цереметрии.
0,1г субстанции (точная навеска) натрия нитрита растворить в 25мл дистиллированной воды. 5мл полученного раствора при постоянном перемешивании внести в коническую колбу, содержащую 7,5мл 0,1моль/л раствора сульфата церия. Колбу быстро закрыть пробкой и оставить на две минуты.
2Ce(SO4)2 + NaNO2 + Н2О ® NaNO3 + Ce2(SO4)3 + H2SО4
Далее в колбу добавить 2,5мл раствора KI (200 г/л) и 0,5мл раствора крахмала. Продолжая постоянное перемешивание, титровать 0,1М раствором натрия тиосульфата до исчезновения синей окраски.
. 2Ce(SO4)2+ 2KI ® I2+ K2SO4 + Ce2(SO4)3
I2 + 2Na2S2O3 ® 2NaI + Na2S4O6
1мл 0,1 моль/л Cе(SO4)2 соответствует 3,45мг NаNO2
Хранение. Препарат хранят в хорошо закрытых банках из оранжевого стекла в сухом темном месте, так как на воздухе он легко окисляется, а на свету частично разлагается (диспропорционирует) и желтеет:
2NaNO2+ H2O ® NO2 + NO + 2NaOH
Висмута субнитрат / Bismuth subnitrate
4[BiNO3(OH)2],BiO(OH) M r 1462
А. Разведите 1 мл раствора С1 до 5мл водой, добавьте 0.3 мл раствора калия йодида. Образуется чёрный осадок, который растворяется при добавлении 2 мл раствора калия йодида и раствор становится оранжевым.
Bi(NO3)3 + 3KI → BiI3↓ + 3KNO3
BiI3 + KI → K[BiI4]
B. Даёт реакцию (б) на висмут (см. Общие реакции). При взаимодействии ионов висмута с тиомочевиной образуются различного состава тиомочевинные комплексы, имеющие лимонно-желтую окраску:
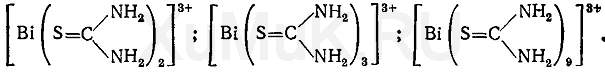
С. Даёт реакцию на нитраты (см. Общие реакции по ЕР)
D. рН раствора С2 не более 2.0
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 600; Нарушение авторских прав?; Мы поможем в написании вашей работы!