
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Бор постулаттары 1 страница
|
|
|
|
Атомның ядорлық (планетарлық) моделі классикалық физика заңдары тұрғысынан орнықсыз. Өйткені классикалық электродинамика заңдарына сәйкес:
1 Үдемелі қозғалатын зарядталған бөлшек (электрон) электромагниттік энергияны (жарық) үздіксіз шығаруға тиіс:
2 Осы жарықтың жиілігі электронның ядроны айналу жиілігіне тең болуы керек.
Демек, осы модельге сәйкес атомның тоық энергиясы үздіксіз кеми беруге, ал айналу жиілігі үздіксіз арта береуге тиіс. Осы жағдайда өте аз уақыт (~10⁻⁸е) ішінде электрон ядроға құлан,атом өзінің өмір сүруін тоқтататындығын есептеп, көз жеткізуге болады. Ал бұл барлық атомдардың өте қысқа уақыт ішінді қиратандығын көрсетеді. Бұған қоса, егер берілген модель дұрыс болса, онда сутегінің оптикалық спектрі (басқа элементтердің спектрі де) үздіксіз,тұтас болу керек. Осы екі қорытынды да тәжірбие деректеріне толығынан қарама-қайшы келеді. Шындығында атом өте орнықты жүйе болып табылады және қозбаған күйде жарық шығармайды, атом сызықтық оптикалық спектір береді. Сонымен, атомның ядорлық (планетарлық) моделі (классикалық механика және электродинамикамен қосылып) атомның орнықтылығын да атомдық спектірдің сызықтық сипатта болатынын да түсіндіре алмады.
Осы тұйыққа тірелуден шығу жолын 1913 ж Дания физигі Нильс Бор (1885-1962) тапты. Ол үшін оған классикалық физика түсініктеріне қайшы келетін жоромалдар енгізуге тура келді. Бор өзінің жорамалдарын екі постулат түрінде ұсынды:
1. Классикалық механика тұрғысынан атомда мүмкін болатын шексіз көп электрон орбиталары ішінен, шындығында mυr nћ (n=1,2,3…) белгілі кванттық шарттарды қанағаттандыратын тек кейбір дискретті орбиталар іске асады. Электрон осы станционарлык орбиталардың күйдегі энергиясының дискретті мәндері (Е1,Е2,Е3,...) болады.
2. Электрон бір стационарлық күйден екінші стационарлық күйге көшкенде ғана жарық энергиясы ћw кванттары түрінде шығарылады немесе жұтылады.
Жарық квантының шамасы араларында электрон кванттык көшу жасайтын стайионарлық күйлер энергияларының айырмасына тең:
ћω = En - Em (2.1)
Осы теңдік Бордың жиіліктер ережесі деп аталады. Сонымен атом стационарлық бір күйден басқа екінші күйге секірмелі түрде ауысады. Бұлар кванттык көшулер деп аталад. Мысалы,егер электрон n= 5 орбитадан (стационарлық күйден) n= 4 орбитаға өткен болса, онда жиілігі ω = (E4– E5) / ћ фотон шығарылады (бұл шығару спектірінің дискреттік сипатын түсіндіреді). Ал егер энергиясы ћω = E4– E5 фотон атоммен соқтығысса, онда-ол жұтылуы мүмкін. Сонда электрон n= 4 орбитадан n= 5 орбитаға көшеді. Жұтылу спектірінің пайда болу механизмі осындай. (2.1) Бордың жиліктер ережесі Ридберг-Ритцтің комбинациялық принципін түсіндіруге мүмкіндіг береді. Осы принципке сәкес спекторскопияяда спектірлік сызықтардың 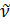 = 1/λ толқындық сандары T(n) термдер депаталатын оң таңбалы сандар айырмасы түрінде бейнеленеді:
= 1/λ толқындық сандары T(n) термдер депаталатын оң таңбалы сандар айырмасы түрінде бейнеленеді:
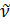 =
=  = T(m) - T(n), n m (2.2)
= T(m) - T(n), n m (2.2)
Спектроскопиялық толқындық сан үшін Бордың (2.1) жиіліктер ережесі мына түрде жазылады:
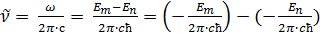 (2.3)
(2.3)
(2.3) және (2.2) теңдіктерін салыстырып, терм атомның стационарлық күйдегі энергиясына тура пропорционал екендігін көруге болады:
 (2.4)
(2.4)
Сөйтіп спектірлік термнің физикалық мағынасы түсінікті болды. Атомның стацонарлық күйлердінің Е1, Е2, Е3, … энергия мәндерінің жиынтығы атомның энергетикалық спектірін түзеді. Сонымен терм атомның энергия деңгейлерімен анықталады.
2.2. Франк-Герц тәжірибелері
Бор постулаттарының дұрыс екендігін неміс физиктері Джеймс Франк (1882-1964)және Густав Герц (1887-1975)жасаған тәжірибелері (1913 ж) айқын көрсетті. Олар тежегін потенциал әдісімен электрондардың газ атомдарымен соқтығысуын зерттеу арқылы атомның энергия мәндері дискретті болатындығын тәжірибе жүзінде дәлелдеді.
Тәжірибенің идеясы мынадай. Электронның атоммен серпімсіз соқтығысуы кезінде электроннан атомға энергия бөлінеді. Егер атомның ішкі энергиясы үздісіз өзгеретін болса, онда атомға энергияның кез келген мөлшері берілуі мүмкін. Егер атом күйлері дискретті болса, онда оның ішкі энергиясы электронмен соқтығысқан кезде де дискретті өзгеруі атомның стационарлық күйлердегі ішкі энергиясының айырымына тең мәндерге өзгеруі тиіс.
Демек серпісіз соқтығысқанда электрон атомға белгілі энергия мөлшерін ғана бере алады. Бұларды өлшеп, атомның стационарлық күйлерінің энергиялары мәндерін анықтауға болады.
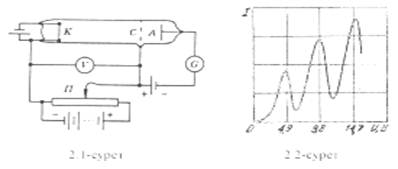 Осыны экспериментте 2.1-суретте схемасы келтірілген қондырғының көмегімен тексеру алға қойылды. Қысымы шамамен 13 Па болатын сынап буымен толтырылған разрядтық түтікте үш электрод бар: К- катод, С- тор, А- анод. Термоэлектрондық эмиссия салдарынан қыздырылған катод пен тор арасындағы U потенциалдар айырымымен үдетіледі. U шамасын бір сыдырғы өзгертуге болады. Тор мен анод аралығында ≈ 0,5 В болатын әлсіз тежеуіш өріс беріледі.
Осыны экспериментте 2.1-суретте схемасы келтірілген қондырғының көмегімен тексеру алға қойылды. Қысымы шамамен 13 Па болатын сынап буымен толтырылған разрядтық түтікте үш электрод бар: К- катод, С- тор, А- анод. Термоэлектрондық эмиссия салдарынан қыздырылған катод пен тор арасындағы U потенциалдар айырымымен үдетіледі. U шамасын бір сыдырғы өзгертуге болады. Тор мен анод аралығында ≈ 0,5 В болатын әлсіз тежеуіш өріс беріледі.
Сонымен егер қандай да бір электрон тордан 0,5В- тан кем энергиямен өтетін болса, онда ол анодқа жете алмайды. Тордан өткен кезде энергиясы 0,5 В- тан артық электрондар ғана анодқа жетіп өлшеуге келетін І анодтық тоқты құрайтын болады.
Тәжірибеде І анодтық тоқтың U үдеткіш кернеуден І (U) тәуелділігі зерттенлген. Алынған нәтижелер 2.2-суретте келтірілген. Максимумдар Е1 =4,9 эВ, Е2 = 2 эВ,Е1 және т.т энергия мәндеріне сәйкес келеді.
І (U) тәуелділігінің осындай түрі атомдардың шынында да 4,9 эВ- қа тең, тек дискретті энергия мөлшерін жұта алатындығымен түсіндіріледі.
ЭЛЕМЕНТТЕРДІҢ ПЕРИОДТЫҚ ЖҮЙЕСІ, химиялық элементтердің жіктелуі – Д.И. Менделеев ашқан периодтық заңның кестелік (графиктік) бейнесі (қ. Менделеевтіңпериодтық заңы). Менделеев элементтерді периодтық жүйеге орналастырғанда олардың атом. салмақтарының өсуіне, сонымен қатар олардың хим. қасиеттерінің өзгеруіндегі периодты заңдылыққа сүйенді. Ол кестедегі кейбір элементтерді (Co – Nі, Te – І) атом. салмақтарының өсу бағытына сай емес, хим. ұқсастығына қарай орналастырды, бірнеше элементтердің сол кезде қабылдаған атом салмақтарын 1,5 – 2 есе өзгертті (Іn, Cl, U, т.б.). Алғашқы кестеде Менделеев әлі ашылмаған бірнеше элементтер бар екенін болжап, оларға кестеде тиісті орын қалдырып, кейбір қасиеттерін күні бұрын айтып берді. Сондай болжанған “экоалюминий” (1875 ж. француз химигі П.Лекок де Буабордан ашқан қазіргі галлий Ga), “экабор” (швед ғалымы Л.Нильсон 1879 ж. ашқан скандий Sc) және “экасилиций” (1886 ж. неміс ғалымы К.Винклир ашқан германий Ge) элементтері кейін ашылды. Сонымен қатар Менделеев марганецке (қазіргі технеций Тс және рений Re), теллурге (полоний Ро), йодқа (астат At), цезийге (франций Fr), барийге (радий Ra), танталға (протактиний Ра) ұқсас элементтердің бар екенін айтқан. Күні бұрын болжанған қасиеттер мен анықталған қасиеттердің дәл келуі Менделеевтің периодты заңын дүние жүзі ғалымдарына танытты. Радиоактивтік ыдыраудың (1806), рентген сәулелерінің (1895) ашылуы, неміс физигі М.Планктің сәуле шығарудың кванттық теориясын (1900), ағылшын физигі Э.Резерфордтың атомның планетарлық моделін (1911) жасауы, Н.Бордың атомның құрылыс теориясын ұсынуы (1913) атомның күрделі табиғаты мен периодтық жүйе құрылымының физ. мәнін түсіндірді. Ағылшын физигі Г.Мозли еңбектерінің нәтижесінде Менделеев ұсынған әр элементтің рет нөмерінің оның ядро зарядымен тең болуы, сондай-ақ атомдағы электрондар санының анықталуы, олардың орналасуындағы периодтық заңның тұтастай ішкі сырын ашты. Бор теориясын әрі қарай неміс физигі А.Зоммерфельдтің дамытуы, кейін швейцариялық физик В.Паули принципінің шығуы электрондық әр қабықта орналасу заңдылығын анықтады. Қазіргі Э. п. ж. 110 хим. элементті қамтиды, олардан трансуран элементтері (Z – 93 – 110) және кейбір элементтер Z – 43 (Tc), 61 (Pm), 85 (At), 87 (Fr) жасанды жолмен алынған. Менделеев периодтық жүйені жасағаннан бері оны кеңістікте немесе жазықтықта орналастырудың графиктік әр түрлі нұсқалары ұсынылғанмен, Менделеевтің ықшамды қысқа және ұзын периодты кесте түріндегі нұсқасы көбірек қолданылады. Э. п. ж-н құрастырудағы негізгі принцип – барлық элементтердегі периодтар мен топтарға бөліп орналастыру. Әр топ өз кезегіндегі негізгі (а) және қосымша (б) топшаларға бөлінеді (периодты кестенің ұзын түрін қара). Топшалардағы элементтер өзара хим. қасиеттері жағынан өте ұқсас. Период деп сілтілік металдан басталып инертті газбен аяқталатын элементтер тобын айтады. Әр периодта 2, 8, 18, 32 элемент болады. Бірінші периодтың ерекшелігі – онда екі элемент қана Н, Не орналасқан. Сутектің сілтілік металдарға да, галогендерге де ұқсайтын ортақ қасиетіне байланысты оны көбіне Іa кейде VІҚа топшаға да орналастырады. Екінші периодтта 8 элемент (Lі – Ne) бар. Ол сілтілік металл литийден Lі басталады, одан кейінгі ІІ валентті Ве металл, ал ІІІ валентті В элементтінің металдық қасиеті кеміп, ІV валентті көміртектен бейметалдар басталады, олардың (N, О, F) тотығу дәрежелері теріс. Период инертті газ – неонмен (Ne) аяқталады. Үшінші периодта да 8 элемент орналасқан (Na – Ar). Олардың қасиеттерінің өзгеру сипаты екінші период элементтеріне ұқсас, дегенмен Mg-мен Al-дің Ве-мен В-ға қарағанда металдық қасиеті басымдау, сондай-ақ бейметалдар – P, S, Cl-дың екінші периодтағы “ұқсастардан” айырмашылығы олар өздеріне тән ең жоғары оң валенттіктерін көрсете алады. Менделеев 2 және 3-период элементтерін типтік элементтер деп атаған, себебі олардың бәрі де табиғатта кең таралған. Алғашқы 3 периодтың элементтері негізгі топшаларға (а) ғана кіреді. Қазіргі технологиялар бойынша бұл периодтардың алғашқы екі элементі (сілтілік және сілтілік-жер металдар) Қа-, ІҚа- топшаларды құрайтын s-элементтерден тұрады (кестеден қызыл түске боялған), қалған алтауы (B – Ne, Al – Ar) ІІҚа, VІІҚа-топшаларды құрайтын р-элементтерден тұрады (кестеде сары түсті). Кіші периодтар деп аталған бұл үш период элементтерінің рет нөмірі артқан сайын атом радиустары кішірейіп, кейінгі атомның сыртқы қабығындағы электрондар саны көбейгенде, олардың өзара ығысуының күшеюінен атом радиустары ұлғая бастайды. Ең үлкен радиус периодтың басында орналасқан сілтілік металға тән. Осындай заңдылық иондар радиусының өзгеруінен де байқалады. Төртінші периодта 18 элемент бар (К – Кr), ол – үлкен периодтардың алғашқысы. Мұнда сілтілік және сілтілік-жер металдардан кейін ауыспалы деп аталатын 10 элемент (Sc – Zn) орналасады. Бұларды d – элементтер деп атайды (кестеде көк түсті), олар да қосымша топшаларға кіреді. Ауыспалы элементтер түгелдей металдар, Fe – Co – Nі триадасынан басқасы өздеріне тән ең жоғары валенттіктерін көрсетеді. Соңғы алты p-элементтер (Ga – Kr) негізгі топшаға (a) кіреді, қасиеттерінің өзгеруі бұрын айтқан ІІ және ІІІ период элементтеріне ұқсас. Бесінші периодта 18 элемент (Rb – Xe) бар, құрылысы төртінші периодқа ұқсас. Одан айырмашылығы ауыспалы элементтер де, ксенон да (Xe) өзіне тән ең жоғары оң валенттіктерін көрсете алады. Соңғы галоген – иодта аздаған металдық қасиет пайда болады. Алтыншы периодта 32 (Cs – Rn) элемент бар. Онда ауыспалы 10 элементпен (La, Hf – Hg) қатар 14 f – элементтер, лантаноидтар (кестеде жасыл түсті) орналасқан. Жетінші периодта да францийден (Fr) басталатын 32 элемент болуға тиісті, бірақ ол әлі аяқталмаған (12 элемент әлі табылған жоқ). Мұнда да алтыншы периодтағыдай 89-элементтен кейін 14 f – элементтер – актиноидтар орналасқан (Th – Lr). Олардың тотығу дәрежесі лантаноидтардан де жоғары болады (ІІІ – VІІ). Лантаноидтар мен актиноидтар кестенің түрі ықшамды болу үшін төменірек жеке екі қатар етіп орналастырылған. Оларды кестедегі өздерінің заңды орнына қойып горизонталь периодтарды ұзартсақ периодтық түр шығады. Онда атомдардың электрондық құрылымына сай ұқсастығын анығырақ байқауға болады. Қысқа кестедегі топ нөмірі, жалпы алғанда, ондағы элементтердің валенттігі электрондар санына сай келеді. Бір топшадағы элементтердің ұқсастығы олардың валенттік қабаттарының электрондық конфигурациясының периодты түрде қайталанып келіп отырғандығымен түсіндіріледі. Элементтер қасиеттерінің периодты түрде қайталануы олардың электрондық құрылымының периодты қайталануымен сай келетіні де осыдан. Атомдардағы электрондық конфигурацияның қалыптасуын жалпы былай көрсетуге болады:
Тік сызықтар кестеде периодтарды бөліп тұрады. Паули принципіне сай әрбір электрон қабығының сыйымд. 2п2, ал ондағы орбиталдар сыйымд. 2(2l+1). Бұдан әрбір периодтың сыйымд. 2, 8, 8, 18, 32, 32... Әр периодтың басы жаңа мәніне сай келетін s – элементтен басталады (Қа-, ІҚа-топшалар), соңы р – элементтермен аяқталады (ІІҚа-VІІІa-топшалар). Үлкен периодтарда (ІV – VІІ) олардың арасына 10 d – элементтер (Іб-VІІІб-топшалар) кіреді. Ауыспалы элементтердің соңғы электрондары ішкері жатқан п-1 қабаттың d – орбиталарын толтырады, ал сыртқы қабатында s2 электрондар сақталады. Сондықтан олар металдық қасиет көрсетеді. Лантаноидтар мен актиноидтардың соңғы электрондары ішкеріден де ішкерірек жатқан п-2 қабаттың f – орбиталарына толады. f – элементтер де түгелдей металдар. Э. п. ж-ның жоғары шегі анықталмаған. Рет нөмірі 101-ден асқан элементтердің өмірі тым қысқа. Теор. болжамдар 114, 126, 164, 184 элементтер атомдарының ядролары біршама берік болуға тиіс деп санайды. Сондықтан оларды қолдан синтездеу мүмкіндігі бар. Периодтағы элементтердің қасиеттері былайша өзгереді: әр период (І-ден басқасы) күшті сілтілік s – металмен басталады, әрі қарай металдық қасиет кеміп, амфотерлі қасиеті бар элементтер басталады, одан бейметалдарға ауысып, бейметалдық қасиет артып, олардың ең күштілері галогендерде байқалады да, инертті элементпен бітеді. Үлкен периодтарда металдық қасиет өте баяу кемиді, өйткені оларда s-тен соң d және f – металдар орналасады, тек соңында ғана бейметалл p-элементтер орналасқан. Негізгі топшалардағы элементтердің металдық қасиеті жоғарыдан төмен қарай атом радиустары ұлғайған сайын кеміп, керісінше бейметалдық қасиет артады. Қосымша топшалардағы элементтерде жоғарыдан төмен қарай металдық қасиет аз ғана артып, немесе аса көп өзгіріске ұшырамайды. Атомдардың электрондық құрылымына тәуелді периодты өзгеретін қасиеттер мен сипаттамалар көп, олардың бастылары: атом радиустары, ион радиустары, иондалу потенциялы, электрон тартқыштық, теріс электрлік, валенттілік, оптик. және магн. қасиеттері, т.б. Элементтерді жай зат ретінде қарасақ, периодты қайталанатын қасиеттердің саны артады, жай заттардың соғылғыштығы, қаттылығы, ұлғаю және сыну коэфф-тері, тығыздығы, стандартты тотығу-тотықсыздану потенциалдары, т.б. периодты өзгеретін қасиеттер элементтер қосылыстарында да кең таралған. Э. п. ж. – периодтық заңның графиктік бейнесі, олар өзара тығыз байланысты, бірін-бірі толықтыра түседі. Екеуі де хим. элементтерді материя дамуының бір сатысы деп қарап, олардың арасындағы табиғи байланысты ашады. Периодты заң химия ғылымына ғана жатпайды, ол бүкіл жаратылыстану және табиғи ғылымдардың ортақ заңы, сондықтан ғылыммен бірге дамып, оны байыта түседі
Сутегі (латынша Hydrogenium), H – элементтердің периодтық жүйесінің VII тобындағы химиялық элемент, атомдық номері 1, атомдық молекуласы 1,00797.
Мазмұны
[жасыру]
· 1 Ашылу тарихы
· 2 Кездесуі
· 3 Қасиеттері
· 4 Физикалық қасиеттері
· 5 Сутегінің химиялық қасиеттері
· 6 Қолданылуы
· 7 Дереккөздер
o 7.1 Сутегінің алынуы
o 7.2 Дереккөздер
Ашылу тарихы
Сутекті алғаш Г.Кавендиш зерттеп, оны «жанғыш ауа» деп атаған (1766). А.Лавуазье сутектің қасиеттерін зерттеп, химиялық элементтер тізіміне қосыпты (1787). «Сутек» терминін орыс химигі М.Ф.Соловьев ұсынды (өз тілінде, 1824).
Сутекті алғаш рет мырышпен тұз және күкірт қышқылын әрекеттестіру аркылы 1776 жылы Г. Кавендиш алған. Ол оған «жанғыш ауа» деген ат берген, себебі ол жай заттардың арасындағы өте жанғыш газ. Ал 1783 жылы А. Лавуазье мен Ж. Менье суды термиялық айырып, ол оттек және сутек элементтерінен тұратынын анықтаған, казіргі колданылып жүрген атауын (Hydrogenium- су тудырушы) француз ғалымы А. Штон де Морво берген (1787 жылы). Оның орысша да, қазақша да аттары осы мағынаны білдіреді.
Кездесуі
Бұл табиғатта таралуы бойынша 9-шы орында тұрған элемент, оның үлесіне жер қыртысының 1,4%-ы тиеді, жер бетінде сутек байланысқан күйде (су, мұнай, тас көмір, т. б.), ал ғарышта 63%-ы болады.
Табиғатта тұрақты екі изотопы 1Н (протий) және 3Н (тритий) кездеседі, жасанды жолмен радиоактивті изотопы 3Н мен өте тұрақсыз 4Н алынған. Сутек - әлемде көп тараған элемент. Массасы бойынша атмосферадағы сутектің мөлшері 3,5 *10 -6% литосфера мен гидросферада – 1%, суда – 11,9%.
Қасиеттері
Сутек иіссіз, ең жеңіл газ, суда ерімейді, палладий, платина, никель, т.б. металдарда жақсы сіңіреді; балқу t - 259,1 °C, қайнау t – 252,6 °C. Сутектің молекуласы екі атомнан тұрады (Н2), диссоциациялану дәрежесі 35000С-та 20%, ал 50000С-та 96%-ға тең. Тотығу дәрежелері +1,-1.
Асыл (инертті) газдар мен асыл металдардан басқа элементтердің көпшілігімен химиялық қосылыстар түзеді. Күшті тотықсыздандырғыш болғандықан
· F2 –мен (қараңғыда - 2520С-та),
· Cl2-мен (жарықта),
· O2-мен (550 °C –тан жоғары) әрекеттесіп тікелей қосылыстар (HF, HCl, H2O) түзеді. Сутекті көптеген металдардың (Cu, Fe, W, Re, т.б.) оксидтеріментотықсыздандырады.
Мысалы:
CuO +H2 =Cu + H2O және Fe3O4 +4H2 =3Fe+ + 4H2O, т.б.
Сутек азотпен әрекеттесіп,
· аммиак (N2+3H2=2NH3),
· күкіртпен күкіртсутек (Н2+S=H2O),
· көміртекпен жоғары температурада метан (C+2H2=CH4) түзеді.
Сілтілік және сілтілік жер металдармен әрекеттесіп гидридтер (LiH, NaH, CaH2, BaH2,т.б.) түзеді. Сутектің аса маңызды реакциясына CO-мен әрекеттесіп, температура, қысым, катализатор әсеріне байланысына әр түрлі органикалық қосылыстар (HCHO, CH3OH т.б.) түзу жатады.
Физикалық қасиеттері
Сутек элементінен тұратын жай зат — сутегі, ол екі атомнан тұрады, формуласы Н2; М(Н2)=2, М=2 г/моль. Бұл түссіз, иіссіз, дәмсіз, өте жеңіл (р=0,09 г/л) газ күйіндегібейметалл, оның қайнау (-252,76°С) және балқу (-259,2°С) температурасы өте төмен. Суда нашар ериді (100 көлем суда 2 көлем газ (t=20°С).[1]
Сутегінің химиялық қасиеттері
Кәдімгі жағдайда сутегі тұрақты зат, ал қыздырғанда кейбір жай заттармен реакцияға түседі. Сутегі оттегінде көзге көрінбейтін жалынмен су түзе жанады. Бұл үдеріс баяу жүреді.
2Н2+ 02 = 2Н20 + 572кДж
Жай заттардан күрделі зат олардың тікелей әрекеттесуі аркылы алынса синтез деп аталады.
Бұл реакцияны жүргізу үшін калың қабырғалы сынауық алып, оны үшке бөліп сыртынан белгілеп алып, 1 бөлік О2, жәнө 2 бөлік Н2 жинап аламыз да (суды ығыстыру арқылы) оны орамалмен ораймыз. Сынауықтың аузына жанған шырпы апарғанда қопарылыс бере реакция жүреді. Сутегі оттегімен шабытты әрекеттеседі, нәтижесінде су түзіліп, жылу бөлінеді.
V(Н2): V(02) = 2: 1 болғанда ғана олар қопарылыс береді, сондықтан осындай қатынаста алынған газ қоспасын «күркіреуік газ» деп атайды. Сутегі хлормен реакцияласқанда өткір иісті хлорлы сутек газын береді.
Н2 + Сl2 = 2HCl↑.
Қыздырылған күкірт арқылы сутегін өткізсек, жағымсыз иісті күкіртті сутек газы түзіледі:
Н2+ S H2S↑
Бейметалдардың сутекпен қосылыстарын атау үшін сутекті қосылыс түзуші, элемент атына ды, ді, ты, ті, лы, лі жалғаулары жалғанып, сутек сөзі қосылып оқылады.
Мысалы: HCl - хлорлы сутек; НВr - бромды сутек; H2S - күкіртті сутек; НҒ - фторлы сутек.
Кейбір бейметалдардың сутекті қосылыстарының тарихи қалыптасқан атаулары бар:
· Н20 - су;
· NH3 - аммиак;
· СН4 - метан;
· РН3 - фосфин;
· SiH4 - силан.
Сутегі өте белсенді металдармен әрекеттескенде гидридтер деп аталатын тұз төрізді қатты заттар түзіледі:
H2+2Na=2NaH натрий гидриді
Н2+Са=СаН2 кальций гидриді
Сутектің металдармен қосылыстарын атау үшін металл атына гидриді деген сөз қосылып оқылады.
Күрделі заттарменәрекеттесуі: Егер мыс (II) оксидін қыздырып, оған сутегін жіберсек мыс оксидінің қара түсі жойылып қызыл түсті мыс бөлінеді:
CuO + Н2 = Н2О+Cu
Бұл реакцияда тотықсыздану үдерісі жүреді, өйткені сутек мыс (II) оксидіндегі оттекті өзіне қосып алады, сөйтіп сутек тотығады, ал мыс тотықсызданады.
Қолданылуы
Өнеркәсіпте сутек метанда конвергенциялау (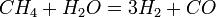 ) несмесе суды электролиздеу (
) несмесе суды электролиздеу (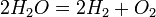 ) арқылы ашылады. Мұнай және химия өнеркәсібінде қосымша өнім ретінде сутек бөлінеді. Лабараторияда сутекті сұйытылған тұз (
) арқылы ашылады. Мұнай және химия өнеркәсібінде қосымша өнім ретінде сутек бөлінеді. Лабараторияда сутекті сұйытылған тұз (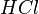 ) немесе күкірт (H2SО4) қышқылдарына мырышпен әсер етіп алады. Дүние жүзінде жылына шамамен 350*109 тонна сутек өндіріледі. Сутек, аммиак, тұз қышқылы, жасанды сұйық отын алуда, майларды гидрогенезациялауда, металдарды сутек-оттек жалынында кесуде, мұнай фракцияларын гидротазалау мен гидрокрекингісінде, тағыда басқа қолданылады. Атом энергетикасында изотоптары маңызды орын алады. Сутекті экологиялық таза орын ретінде қолданудын болашағы зор (
) немесе күкірт (H2SО4) қышқылдарына мырышпен әсер етіп алады. Дүние жүзінде жылына шамамен 350*109 тонна сутек өндіріледі. Сутек, аммиак, тұз қышқылы, жасанды сұйық отын алуда, майларды гидрогенезациялауда, металдарды сутек-оттек жалынында кесуде, мұнай фракцияларын гидротазалау мен гидрокрекингісінде, тағыда басқа қолданылады. Атом энергетикасында изотоптары маңызды орын алады. Сутекті экологиялық таза орын ретінде қолданудын болашағы зор (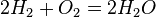 ).
).
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1474; Нарушение авторских прав?; Мы поможем в написании вашей работы!