
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Бор постулаттары 2 страница
|
|
|
|
Сутектің қолданылуы, оның жанғанда көп жылу бөлінетіндігіне негізделген. Әсіресе экологиялық таза отын ретінде сутектің болашағы зор. Себебі сутек жанғанда түзілетін өнім – су ауаны ластамайды. Әзірше сутекті көп мөлшерде метан мен судан алу қымбатқа түседі. Сутектің тиімдіракета отыны болатыны туралы кезінде Ц.Е.Циолковский де айтқан. Қазіргі кездегі негізгі энергия көзі – табиғи газ, мұнай, таскөмір. Жер қыртысындағы олардың қоры да шектеулі. Оның үстіне бұл аталған шикізаттарды пайдалануды сыртқы ортаның ластануына жол беріледі.
Дереккөздер
Химия 8 сынып оқулығы
Сутегінің алынуы
Сутектің жерде кездесетін ең мол көзі - су,  сондықтан оны өндірісте суды тұракты электр тогының көмеимен айыру арқылы алады: 2Н2O = 2Н2↑ +02 ↑ бұл реакцияны алғаш рет А. Лавузье мен Ж. Менье қыздыру арқылы іске асырған (жоғары бағытталған бағдарша заттың үшқыштығын көрсетеді).
сондықтан оны өндірісте суды тұракты электр тогының көмеимен айыру арқылы алады: 2Н2O = 2Н2↑ +02 ↑ бұл реакцияны алғаш рет А. Лавузье мен Ж. Менье қыздыру арқылы іске асырған (жоғары бағытталған бағдарша заттың үшқыштығын көрсетеді).
Сутегіні ендірістік мақсатта алудың басқа да тәсілдері бар.
Ал зертханаларда белсенді металдын, (Zn, Mg) қышқылдармен әрекеттесу реакциясы арқылы алады. Көп жағдайда мырышты пайдаланады.  ↑
↑
Бұл реакцияны жүргізу үшін газ өтетін түтігі бар сынауыққа 2-3 түйір мырыш салып, үстіне сұйытылған тұз немесе күкірт (H2S04) қышкылын құямыз. Сонда металл бетінен газ көпіршіктері (Н2) көтеріле бастайды. Бөлінген сутегін судың астында жинауға болады, өйткені сутегі суда нашар ериді немесе ауаны ығыстыру арқылы жинауға болады. Сутегіні жинайтын ыдыс төңкеріліп ұсталуы тиіс. Себебі сутегі ауадан 14,5 есе жеңіл.  Енді осы тәжірибені күкірт қышқылымен жүргізейік:
Енді осы тәжірибені күкірт қышқылымен жүргізейік:  ↑ Бұл реакцияларда белсенді металл қышқыл құрамындағы сутектің орнын басып тұр, олай болса реакция типі - орын басу.
↑ Бұл реакцияларда белсенді металл қышқыл құрамындағы сутектің орнын басып тұр, олай болса реакция типі - орын басу.
| белсенді металл + қышқыл = тұз + сутек газ |
Осылайша алынған сутегінің тазалығы тұрған спирт шамына немесе шырпыға сутек жиналған сынауықты апарамыз, сонда сутегі таза болса баяу «пах» деген дыбыс шығарады, ал таза болмаса (сынауықтағы ауа толығынан ығыспаса) дыбыс қаттырақ естіледі. Сутегіні алу үшін өте белсенді металдар қолданылмайды, ол экономикалық жағынан тиімсіз. Металдың белсенділігі өте жоғары болғанда (К, Na, Са) олар сутекті судың құрамынан да ығыстыра алады: 2Na + 2HOH = 2 NaOH + Н2 ↑
Бұл реакция ете шабытты жүреді, бөлінген сутегінің өсерінен металдың түйіршігі су бетінде айнала қозғалып («жүгіріп») жүреді. Дәл осындай реакция кальцийді алғанда да байқалады. Са+ 2НОН = Са (ОН)2+ Н2↑

Кипп аппараты
Зертханаларда сутегін және басқа да газдарды (С02, H2S, т.б.) қажеттілігіне қарай дүркін-дүркін алып түру үшін арнайы құрылғы қолданылады, ол «Кипп аппараты» деп аталады.
Бұл екі бөлімнен тұратын калың кабырғалы шыныдан жасалған құрал:
· астыңғы бөлігі өзара байланысқан шар мен жарты шар пішінді етіп жасалған (1),
· ал үстіңгі бөлігі ұзын түтігі бар шар тәрізді үлкен құйғы (2).
· Астыңғы бөлігінің шар және жарты шары арасында қышқылға төзімді
материалдан жасалған зат түйірлерін (Me, СаС03, FeS т. б.) үстап түратын сақинасы (3),
· ал астыңғы жарты шардың табанына тақау жерде шүмегі (4)
бар.
· Астыңғы бөлігінің шар тәріздес бөлімінде тесігі бар, оған газ шығатын түтік қойылған, онда газдың ағынын реттеп тұратын шүмегі (5) бар.
Кипп аппаратының жұмыс істеу реті мынадай:
1. Ортаңғы беліміндегі сақина үстіне зат түйіршіктерін (Me, СаС03, FeS) салу.
2. Астыңғы жарты шардың шүмегін (4) жабу.
3. Құйғыға (2) қышқыл ерітіндісін абайлап құю.
4. Ортаңғы бөліктегі шүмекті (5) ашқанда төменгі жарты шардан қышқыл көтеріліп, сақина үстіндегі затпен жанасады да реакция басталады.
5. Бөлінген сутегін жинау.
6. Сутегін жинап алғаннан кейін шүмекті жапканда газ қысуының салдарынан қышқыл кері қарай құйғы бойымен көтеріледі.
7. Оның тазалығын тексеру.
Иондық Химиялық байланыс электр терістілігі бойынша айырмашылығы үлкен металл мен бейметалл атомдары арасында түзіледі. Химиялық әрекеттескенде валенттік электрондарын беріп, оң зарядты иондарға (катиондарға): К־–е–К+ бейметалл атомдары электрондар қосып алып, теріс зарядты иондарға (аниондарға) айналады: Cl+е–Cl־. Әр аттас зарядты иондар бірін-бірі тартып молекула құрайды: K+ + Cl ־= KCl. Иондық Химиялық байланыс қарама-қарсы зарядталған иондардың электрстатикалық тартылысы нәтижесінде жүзеге асады. Иондар түзілу арқылы жүзеге асатын байланыстарды иондық байланыс, қосылыстың өзін иондық қосылыс деп атайды. Иондық қосылыстардың қайнау, балқу темп-расы жоғары, қызуға тұрақты, олар полюстік еріткіштерде тез ериді, ерітінділері электр тогын жақсы өткізеді.
Ковалентті Химиялық байланыста — әрекеттесуші атомдарға ортақ электрондар жұбы пайда болып, олардың санына қарай бір немесе бірнеше еселенген байланыстар түзіледі. Мысалы, сутек молекуласы атомдары арасында бір (Н:Н), оттек молекуласында қос (:О::О:), азот молекуласында үш (:N:::N:) еселенген ковалентті Химиялық байланыс бар. Ковалентті Химиялық байланыстар электрон жұбының атомдардың арасында орналасуына қарай полюсті және полюссіз деп екіге бөлінеді.
Полюсті молекулада Химиялық байланыс түзетін ортақ электрондар электр терістілігі күшті атомға ығыса орналасады. Молекуланың полюстілігі диполь моменті арқылы көрсетіледі. Полюстік молекулалардың қайнау және балқу температурасы төмен, полюсті еріткіштерде үйектеліп иондарға ыдырайды.
Полюссіз ковалентті Химиялық байланысты молекулада электрон жұбы атомға ауыспай, симметриялы түрде ортада орналасқан. Полюссіз Химиялық байланыстағы қосылыстардың қайнау және балқу температуралары төмен, полюсті еріткіштерде иондар түзбейді, электр тоғын өткізбейді. Ортақтаспаған электрон қосағынан және электронсыз бос орбитасы бар атомдардан (донар-акцепторлы) түзілетін сутектік және металдық Химиялық байланыстар координациялық байланыс деп аталады. Сутекті Химиялық байланыс — екі не бір молекуладағы атомдар арасында сутек атомының оң заряды арқылы түзіледі.
Металдық Химиялық байланыс — металл атомдарының сыртқы қабатындағы бос электрондар қатысуымен түзілетін байланыс. Химиялық байланыс валенттік электрондар арқылы жүзеге асады.
Химиялық байланысының негізгі сипаттамалары:
· байланыс энергиясы,
· байланыс ұзындығы,
· валенттік бұрыш.
Байланыс энергиясы — өзара байланысқан атомдарды не иондарды бір-бірінен ажырату үшін жұмсалатын энергия. Байланыс ұзындығы — Химиялық байланыстағы атомдар ядроларының арасындағы қашықтық, валенттік бұрыш — байланысқан атомдар ядролары арқылы жүргізілетін жорамал сызықтар арасындағы бұрыш. Бұл көрсеткіштер зат молекуласының құрылысын, пішінін және беріктігін сипаттайды.
Химиялық байланыстардың түрлері[өңдеу]
Химиялық байланыс түзілген кезде әрекеттесуші атомдардың сыртқы электрондық қабаттарында өзгерістер жүреді. Байланыстың төрт түрі болады.
Ковалентті байланыс[өңдеу]
Ковалентті байланыс ортақ электрон жұбы түзілу арқылы іске асады.
Химиялық байланыстың түзілуін электртерістілік ұғымын қолданып түсіндіруге болады.
Электртерістіліктері бірдей элемент атомдарының арасында (Н2, О2, N2, С12) байланыста болатын сутек молекуласының түзілу мысалында қарастырайык. Сутек атомының электрондық формуласы 1s1. Сутектің электротерістілігі 2,1. S-электрондарының электрон бұлттары сфера (шар) тәрізді, олардың өзара әсерлесуін былай көрсетуге болады:
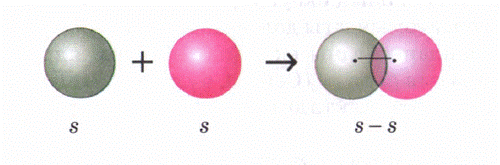
Cонда s электрондарының бұлттары өзара қабысып, екі электрон екі ядроға да ортақ, олардан бірдей қашықтықта орналасады. Бірдей атомдардың арасындағы байланыс полюссіз ковалентті байланыс деп аталады. Электрон бұлттары қабысуы нәтижесінде энергия бөлініп, молекула түзіледі. Бұл энергия шамасы молекуладағы байланыс беріктілігін сипаттайды, олай болса молекула жеке атомдарға қарағанда тұрақты жүйе болғаны.
Полюссіз ковалентті байланыста байланыстырушы электрон жұбының бұлты ядролардан бірдей қашықтықта орналасады.
Молекулалардың құрылымдық формулаларында бір электрон жұбына бір сызықшаға (-) сейкес келеді. Сутек атомдарының валенттіліктері I, себебі валенттілік байланыс түзуге жұмсалған электрондар санымен анықталады. Сутегі молекуласындағы элементтердің тотығу дәрежелері нөлге тең, себебі атомдардың электртерістіліктері бірдей, электрондар жұптары екі элемент ядросынан бірдей қашықтықта орналасады.
Енді оттегі молекуласындағы байланыстың түзілуін қарастырайық.
Оттек атомының электрондық формуласы 1s22s22p4, валенттілік электрондары 2s22p4, электртерістілігі 3,5.

Электронды-графикалық формуласын қарасақ, валенттілік электрондар саны 6, оның екеуі дара күйінде, міне, осы электрондар екінші оттек атомындағы дәл осындай электрондармен екі жұп түзеді, яғни байланыс саны екі. Енді әр атом ядросын 8 электроннан айналатын болады. Сөйтіп, бұл мысалдан да көретініміз молекула түзілгенде аяқталған 8 электронды қабаттың пайда болуы.
Оттек атомдарының тотығу дәрежелері нөлге тең, валенттіліктері ІІ-ге тең болады. Еселі байланыс дара байланысқа қарағанда беріктеу болады.
Электрондардың электрон бұлттарының формаларын қолданып байланыстың түзілуін көрсетсек:

α - байланыс дегеніміз электрон бұлттарының қабысу ауданы ядролардың қосылу сызығының бойында жатқанда түзілетін байланыс (а). Ал pi-байланыс — электрон бұлттарының қабысу ауданы ядроларды қосатын сызықтың екі жағында орналасқанда түзіледі (ә).
Оттегі молекуласында атомдар бір-бірімен екі байланыспен байланысқан, оның бірі - α болса, екіншісінің - пи –байланыс екендігін байқайсыңдар.
Олай болса пи -байланыс, тек қайталанған байланыстарда болса, α -байланыс дара байланыс кезінде түзіледі.
Полюсті коваленттік байланыс дегеніміз байланыстырушы электрон жұбының бұлты электртерістігі басым элемент атомына қарай ығыса орналасқан байланыс.[3]
Иондық байланыс[өңдеу]
Иондық байланыс - иондардың арасында электрстатикалық тартылыс күшінің әсерінен түзілетін байланыс.
Оң зарядты иондар - катиондар, ал теріс зарядты иондар - аниондар.
Нағыз металдар (I, ІІА) мен нағыз бейметалдардың (VI-VIIА) арасында иондық байланыстар түзіледі.
Иондық байланыс тұздарда, негіздерде және қышқылдарда да байқалады.
Иондардың зарядтары араб цифрларынан кейін көрсетіліп, элемент таңбасының оң жағын ала жазылады.[3
Атом құрылысы - 1897 жылы көптеген электр құбылыстарын түсiндiруге мүмкiндiк беретiн жаңалық ашылды. Ағылшын ғалымы Дж. Дж. Томсон элементар заряд тасымалдаушысы болып табылатын бөлшектi тапты. Бұл бөлшекті электрон деп атады.[1][2]
Мазмұны
[жасыру]
· 1 Электрон
· 2 Атом құрылысы
· 3 Басты фактілер
· 4 Дереккөздер
Электрон[өңдеу]
Электрон массасы m=9,1*10-31 кг-ға тең және табиғаттағы ең жеңiл сутегi атомы массасынан 3700 еседей аз болып шықты. Электр зарядын арттыруға және азайтуға болады. Яғни олар әр түрлі мәнге ие болуы мүмкін. Ендеше электр заряды физикалық шама. Екіэлектрометр алып олардың біреуін зарядтайық. Сосын оқшаулағыш тұтқасы бар жіңішке сыммен екі электрометрді жалғайық. Сонда біз зарядтың теңдей екіге бөлінгенін көре аламыз. Атом құрылысы 1911 жылы ағылшын ғалымы Э. Резерфорд басқарған тәжiрибелер нәтижесiнде ашылған. Электрон заряды терiс: qэл = – е = – 1,6 • 10–19(дәрежесі) Кл.

Оң зарядқа кіргізілген электрондар
Бұл заряд электронның ерекше сипаттамасы болып табылады. Жәй денелердi зарядтауға немесе разрядтауға болады, ал электронды зарядынан “айыру” мүмкiн емес. Сондай-ақ электрон зарядын азайтуға немесе көбейтуге болмайды. Электрон заряды барлық уақытта тек бiр мәнге ие. Химия курсынан сiздер электронның атом құрамына кiретiнiн бiлесiздер. Электрондар атом ішінде орналасқан оң зарядталған атомдық ядроны айнала қозғалады. Резерфорд тәжiрибелерiн жоғары сыныптарда егжей-тегжейлi қарастырылады. Мұнда бiз оның тәжiрибе нәтижесiнде жасаған қорытындыларымен шектелемiз.[3]
Атом құрылысы[өңдеу]
Резерфорд атомының құрылысын Күн жүйесiне ұқсатты. Күн жүйесiндегi планеталар оған тартылып айналғаны сияқты, электрондар да ядроға тартылып оны айнала қозғалады. Осындай ұқсастығы үшiн Резерфорд ұсынған модельдi планетарлық модель деп атаған. Ядро мен электронның ара қашықтығы олардың өлшемдерiне қарағанда өте үлкен. Егер атомды ойша үлкейткенде ядроның диаметрi он теңгелiктей болса, онда ядро мен электрон ара қашықтығы шамамен бiр километрдей болар едi. Егер барлық электрондар атомдық ядроларға тығыз орналасса, онда ересек адамның денесiнiң көлемi бiр куб миллиметрдiң миллионнан бiр бөлiгiндей болатындығы есептелген. Бұдан адам денесiнiң 99%-ын (кез-келген дененiң) бостық жайлайтындығын көремiз. Бiр тектi атомдар жиынтығы химиялық элемент деп аталады. Әр түрлi химиялық элементтердiң атомдары бiр-бiрiнен ядроларының зарядымен және сол ядроны айнала қозғалатын электрондар санымен ерекшеленедi. Мысалы, сутегi атомында жалғыз электрон бар, оттегi атомында – сегiз электрон, ал уран атомында – тоқсан екi. Атомдағы электрондар саны элементтiң Д.И. Менделеев кестесіндегі реттiк нөмiрiмен сәйкес келедi. Осы нөмiр атом ядросының зарядын да анықтайды. Белгiлеу енгiзейiк: Z – элементтiң реттiк нөмiрi, е = атомдағы электрондар саны. Онда атом ядросының және атомдағы барлық электрондардың жалпы заряды үшiн былай жазуға болады: qядро = + Ze, qэл-н = – Ze. Атомдағы электрондардың жалпы зарядын, атом ядросының зарядына қоссақ нөл шығады. Бұл атомның толықтай бейтарап екендiгiн көрсетедi. Бейтарап атомдардан тұратын заттардың молекулалары да бейтарап болады. Кейбiр жағдайларда (мысалы, соқтығысқанда) атомдар бiрнеше электронын жоғалтуы мүмкiн. Атомдар электрондармен бiрге өздерiнiң терiс зарядының бiр бөлiгiн жоғалтып, бейтарап емес жүйеге айналады. Осының салдарынан пайда болған оң зарядталған атомды оң ион деп атайды. Керi жағдайлар да болуы мүмкiн: бейтарап атом өзiне артық электрон қосып алып, терiс зарядталады. Мұндай атомды терiс ион деп атайды.[4]
Басты фактілер[өңдеу]
· Атом ортасында оң зарядталған ядродан және оның қабықшасын құрайтын, орасан зор жылдамдықпен қозғалатын электрондардан тұрады
· Элементар электр заряды е=-1,6*10-19 Кл. Электронның массасы m =9,1 * 10-31 кг
· Ядроның құрамына оң зарядталған бөлшек протон және нейтрон деп аталатын бейтарап бөлшек кіреді
· Ядродағы нейтрондардың саны протондардың санына тең
· Ядроның заряды оң және абсолют мәні бойынша атомдағы барлық электрондардың зарядына тең
· Оң ион-кандай да бір өзара эрекеггесу нәтижесінде электрондарынан айрылған атом
· Теріс ион - қандай да бір өзара әрекеттесу нәтижесінде артық электрондарды қосып алған атом
· Атомның өлшемі өте кіші 10-10 м
· Атом ядросының өлшемі (10-14 м), атомнан он мың есе кіші.
Ядролық күштер, атом ядросын құрайтын нуклондардың арасына әсер ететін және ядроның құрылысы мен қасиеттерін (электрмагниттік күштермен бірге) анықтайды. Ядролық күштердің басқа күштерден (мысалы, гравитациялық және электр-магниттік күштер) өзгеше қасиеттері бар. Оларды қысқаша айтсақ төмендегідей: 1) ядродағынуклондар арасында әсер ететін күштің шамасы атомның электрондық қабықтарында әсер ететін күштің шамасынан әлдеқайда артық. Сондықтан да нуклонды атомядросынан сыртқа қарай бөлініп шығару үшін млн-даған эВ-қа тең энергия жұмсалуы керек. 2) Ядролық күштер электр-магниттік және гравитациялық күштерге қарағанда өте қысқа қашықтыққа әсер ететін күш болып есептеледі. Егер екі нуклонның арасындағы қашықтық 10–13 см-ден асса, онда ядролық күштердің шамасы нөлге дейін кемиді. Нуклондар 10–13 см) деп атайды. 3) Ядродағы× ×арасындағы қашықтық артқан жағдайда, Ядролық күштердің шамасы кеми бастайды. Ядролық күштердің кенет кеми бастайтын қашықтығын ядролық күштердің әсер ету радиусы (r0~2–3 нуклондар өзіне жақын орналасқан нуклондармен ғана әсерлеседі. Ядролық заттың тығыздығы әр түрлі ядрода да шамамен бірдей. 4) Нуклондар арасындағы өзара әсер күші қашықтыққа ғана байланысты емес, сонымен бірге нуклондар спиндерінің бағдарлануына да байланысты. 5) Ядролық күштердің шамасы өзара әсерлесетін нуклондардың электр зарядына тәуелді емес. Ядролық күштердің дәйекті теориясы әзірше жасалып біткен жоқ. Алайда тәжірибелер ядродағы нуклондардың өзара әсерлері пиондар алмасу арқылы жүзеге асатынын дәлелдейді.
Байланыс энергиясы — байланысқан жүйені (мысалы, атом, молекула, атом ядросы, т.б.), оны құрайтын бөлшектерге (құраушыларға) жіктеуге және оларды бір-бірінен арасында өзара әсер болмайтындай қашықтыққа алыстату үшін жұмсалатын энергия; біртұтас жүйе болып байланысқан бөлшектер жиынтығының сипаттамасы.[1]
Мазмұны
[жасыру]
· 1 Жалпы мәліметтер
· 2 Ядролық күштер
· 3 Нуклондардың ядродағы байланыс энергиясы
· 4 Дереккөздер
Жалпы мәліметтер[өңдеу]
Байланыс энергиясының шамасы бөлшектер арасындағы өзара әсерге байланысты анықталады. Егер бөлшектер жиынтығы молекулақұрайтын атомдар болса, онда Байланыс энергиясы ретінде химикалық байланыстың, ал бөлшектер жиынтығы ядро құрайтыннуклондар (протондар мен нейтрондар) болса, онда ядролық байланыстың энергиясы қарастырылады.
Байланыс энергиясы — теріс таңбалы шама. Өйткені байланысқан жүйенің түзілуі кезінде энергия бөлініп шығады. Байланыс энергиясының абсолют шамасы жүйе байланысының беріктілігін және жүйенің орнықтылығын сипаттайды. Басқаша айтқанда, Байланыс энергиясы артқан сайын жүйе берік болады, яғни жүйені оны құрайтын бөлшектерге жіктеу үшін жұмсалатын энергия да көп болады. Мысалы, молекулалардың химикалық Байланыс энергиясы бірнеше эВ болса, ядролық Байланыс энергиясы миллиондаған эВ-қа дейін жетеді. Сондықтан атом ядросы өте берік жүйе болып есептеледі.
Атом ядросының Байланыс энергиясы ядродағы нуклондардың күшті өзара әсеріне байланысты анықталады. Ядроның Байланыс энергиясы: толық, меншікті және жеке бөлшектіктің Байланыс энергиясы болып ажыратылады. Толық Байланыс энергиясы — ядроны жеке нуклондарға ыдырату үшін жұмсалатын энергияға немесе жеке нуклондардан ядро құралғанда бөлініп шығатын энергияға тең.
Меншікті Байланыс энергиясының шамасы өте жеңіл және аса ауыр ядролардан басқалары үшін тұрақты шама (жуық шамамен 8,6 МэВ) болады. Меншікті Байланыс энергиясы ауыр ядролар үшін біртіндеп кеми келе уран ядросында (238U) 7,5 МэВ-қа жуықтайды. Бұл байланыстың сипатынан энергия алу үшін, ауыр ядролардың бөлінуі және жеңіл ядролардың бірігуі тиімді екендігі көрінеді. Ауыр ядроларды бөлу арқылы энергия алу ядролық реакторда жүзеге асырылады. Ал жеңіл ядролардың бірігуі кезіндегі энергияның бөлініп шығу процесі термоядролық реакцияда байқалады. Ядро құрамындағы жеке бөлшектің (протон, нейтрон, α-бөлшек т.б.). Байланыс энергиясы деп сол жеке бөлшекті ядродан бөліп алуға қажетті энергия мөлшерін айтады.
Атом не молекула электрондарының Байланыс энергиясы электр магниттік өзара әсер арқылы анықталады және ол әрбір электронның иондалу потенциалына пропорционал болады (мыс., сутек атомының орнықты күйіндегі Байланыс энергиясы 13,6 эВ-ке тең). Молекула мен кристалдардың Байланыс энергиясы да осындай әсерлерге байланысты болып келеді. Ал гравитациялық өзара әсердің Байланыс энергиясының шамасы өте аз және ол кейбір ғарыштық объектілерде ғана байқалады.[1][2]
Ядролық күштер[өңдеу]
Әлемдегі іргелі әрекеттесу күштерінің екі түрі — гравитациялық және электромагниттік күштері бар.
Атом ядросындағы аттас оң зарядталған протондардың арасында  қуатты электростатикалық тебіліс күші бар екені белгілі. Ауыр элементтердің ядроларында, мысалы,
қуатты электростатикалық тебіліс күші бар екені белгілі. Ауыр элементтердің ядроларында, мысалы, 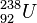 уранда 92 протон бар, олардың бір-бірімен тебілу күші бірнеше мыңдаған ньютонға жетеді. Сонда бір-бірінен тебілетінпротондарды,электр заряды нөлге тең нейтрондарды ядрода ұстап тұрған қандай күш?
уранда 92 протон бар, олардың бір-бірімен тебілу күші бірнеше мыңдаған ньютонға жетеді. Сонда бір-бірінен тебілетінпротондарды,электр заряды нөлге тең нейтрондарды ядрода ұстап тұрған қандай күш?
Массаларына байланысты протондар мен нейтрондарды ұстап тұрған гравитациялық күш  шығар деген пайымдау жасауға болар еді. Алайда, жүргізілген есептеулер, ядродағы екі протонның арасындағы гравитациялық тартылыс күші, олардың арасындағы электростатикалық кулондық тебіліс күшінен кіші екенін көрсетті: Fγ/Fэл = 10-36.
шығар деген пайымдау жасауға болар еді. Алайда, жүргізілген есептеулер, ядродағы екі протонның арасындағы гравитациялық тартылыс күші, олардың арасындағы электростатикалық кулондық тебіліс күшінен кіші екенін көрсетті: Fγ/Fэл = 10-36.
Атом ядроларының тұрақтылығы ядролардың ішінде осы күнге дейін белгілі күштерден табиғаты мүлдем ерекше аса зор тартылыс күшінің бар екенін дәлелдейді.
Ядродағы нуклондарды ыдырап кетуден сақтап, оның берік байланысын қамтамасыз ететін күштер ядролық күштер деп аталады.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1219; Нарушение авторских прав?; Мы поможем в написании вашей работы!