
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение алкенов
|
|
|
|
Номенклатура алкенов
По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ен:
2 атома С → этан → эт ен;
3 атома С → пропан → проп ен и т.д.
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь (т.е. она может быть не самой длинной).
Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение двойной связи, ставится обычно после суффикса –ен. Например:
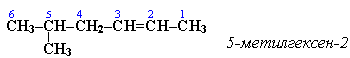
Для простейших алкенов применяются также исторически сложившиеся названия: этилен (этен), пропилен (пропен), бутилен (бутен-1), изобутилен (2-метилпропен) и т.п.
В номенклатуре различных классов органических соединений наиболее часто используются следующие одновалентные радикалы алкенов:
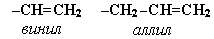
В природе алкены встречаются в значительно меньшей степени, чем предельные углеводороды, по-видимому, вследствие своей высокой реакционной способности. Поэтому их получают с использованием различных реакций.
I. Крекинг алканов:
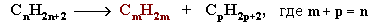
Например:
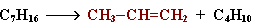
II. Отщепление (элиминирование) двух атомов или групп атомов от соседних атомов углерода с образованием между ними p-связи.
1. Дегидрогалогенирование галогеналканов при действии спиртового раствора щелочи
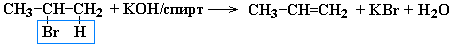
2. Дегидратация спиртов при повышенной температуре (выше 140° C) в присутствии водоотнимающих реагентов
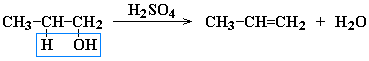
Реакции элиминирования идут в соответствии с правилом Зайцева:
Отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
Современная формулировка: реакции отщепления идут с образованием более замещенных при двойной связи алкенов.
Такие алкены обладают более низкой энергией.
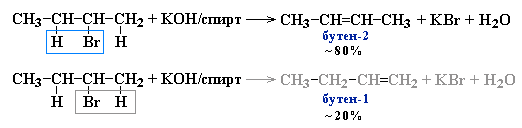
3. Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов:
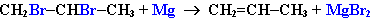
4. Дегидрирование алканов при 500°С:
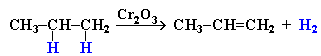
Правило Зайцева — в органической химии эмипирическое правило, используемое для предсказания преобладающего продукта в реакциях отщепления воды или галогеноводородов от спиртов и галогенидовсоответственно. Правило формулируется следующим образом: при дегидратации вторичных и третичных спиртов и при дегидрогалогенировании вторичных и третичных галогенидов водород отщепляется преимущественно от наименее гидрогенизированного атома углерода[1].
Правило предложено русским химиком А. М. Зайцевым в 1875 году.
В целом, правило Зайцева предсказывает образование более устойчивого, более замещённого алкена, однако из этого правила существует ряд исключений.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 662; Нарушение авторских прав?; Мы поможем в написании вашей работы!