
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Номенклатура аминов
|
|
|
|
Пространственная изомерия
Структурная изомерия
- углеродного скелета, начиная с С4H9NH2:
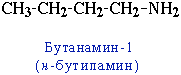
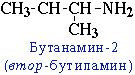
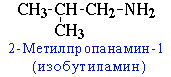
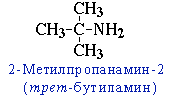
- положения аминогруппы, начиная с С3H7NH2:
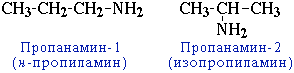
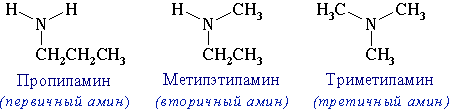
- изомерия аминогруппы, связанная с изменением степени замещенности атомов водорода при азоте, т.е. между типами аминов:
Возможна оптическая изомерия, начиная с С4H9NH2:
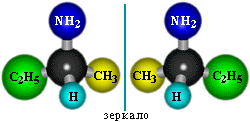
· В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса амин.
CH3-NH2 Метиламин
CH3-CH2-NH2 Этиламин
Различные радикалы перечисляются в алфавитном порядке.
CH3-CH2-NH-CH3 Метилэтиламин
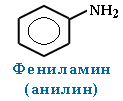
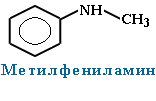
При наличии одинаковых радикалов используют приставки ди и три.
(CH3)2NH Диметиламин
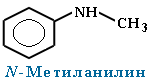
· Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2. В этом случае аминогруппа указывается в названии суффиксами амин (одна группа -NH2), диамин (две группы -NH2) и т.д. с добавлением цифр, отражающих положение этих групп в главной углеродной цепи.Например:
CH3-CH2-CH2-NH2 пропанамин-1
H2N-CH2-CH2-CH(NH2)-CH3 бутандиамин-1,3
· Для аминов, содержащих две группы -NH2, соединенных с неразветвленной углеродной цепью или с циклом, используется название двухвалентного углеводородного радикала и суффикс диамин:
H2N-CH2-CH2-CH2-CH2-NH2 тетраметилендиамин
· Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов анилин. 
Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
38) Строение молекулы анилина. Взаимное влияние атомов в молекулах на примере анилина. Кислотно-основные свойства анилина. Реакции замещения в бензольное кольцо. (Сравнение с аммиаком и аминами). (Сравнение с бензолом). 3Br2. - 3HBr. Br2 / FeBr3. - HBr. Увеличение основных свойств. + HCl. NH3 + HCl. NH4Cl. CH3CH2NH2 + HCl. CH3CH2NH3Cl. NH3. CH3CH2NH2. Масштабная модель молекулы анилина. +.? Хлорид фениламмония. +.? 2,4,6-триброманилин. Хлорид аммония. +.? Хлорид этиламмония. +М-эффект. Бромбензол.
39) Основность аминов
Для аминов характерны ярко выраженные основные свойства (за что их часто называют органическими основаниями).
1. Водные растворы алифатических аминов проявляют щелочную реакцию, т.к. при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
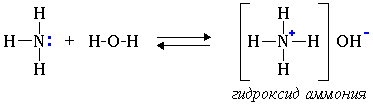
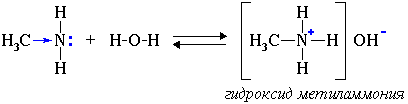
Связь протона с амином, как и с аммиаком, образуется по донорно-акцепторному механизму за счет неподеленной электронной пары атома азота.
Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет + I -эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами.
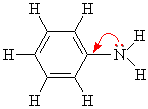 или
или 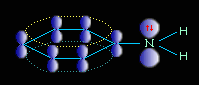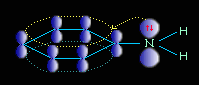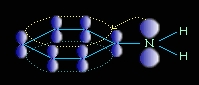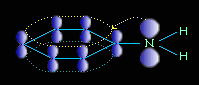
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот. Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида.
2. Взаимодействуя с кислотами, амины образуют соли:
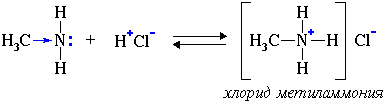
Соли аминов – твердые вещества, хорошо растворимые в воде. Щелочи (более сильные основания) легко вытесняют из них амины:

Способность к образованию растворимых солей с последующим их разложением под действием оснований часто используют для выделения и очистки аминов, не растворимых в воде. Например, анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси, а затем, добавив раствор щелочи (нейтрализация водного раствора), выделить анилин в свободном состоянии.
На основность аминов влияют различные факторы: электронные эффекты углеводородных радикалов, пространственное экранирование радикалами атома азота, а также способность образующихся ионов к стабилизации за счет сольватации в среде растворителя. В результате + I -эффекта алкильных групп основность алифатических аминов в газовой фазе (без растворителя) растет в ряду: первичные < вторичные < третичные. Однако в растворах оснoвные свойства третичных аминов проявляются слабее, чем у вторичных и даже первичных аминов, так как три радикала создают пространственные препятствия для сольватации образующихся аммониевых ионов. По этой же причине основность первичных и вторичных аминов снижается с увеличением размеров и разветвленности радикалов.
Основность ароматических аминов зависит также от характера заместителей в бензольном кольце. Электроноакцепторные заместители (-F, -Cl, -NO2 и т.п.) уменьшают основные свойства ариламина по сравнению с анилином, а электронодонорные (алкил, -OCH3, -N(CH3)2 и др.), напротив, увеличивают.
Основность простейших аминов (в растворе) возрастает в ряду:
C6H5NH2 < NH3 < (CH3)3N < CH3NH2 < (CH3)2NH
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2614; Нарушение авторских прав?; Мы поможем в написании вашей работы!