
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Экзаменационный билет № 5
|
|
|
|
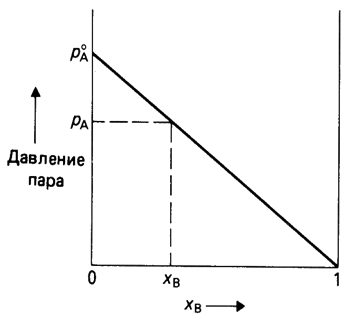
Понижение давления насыщенного пара над раствором
Законы Рауля.
|

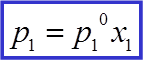 | |||
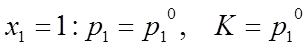 | |||
Первый закон Рауля: давление насыщенного пара растворителя над раствором равно произведению его давления над чистым растворителем на мольную долю растворителя
Первый закон Рауля: Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества
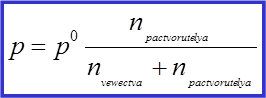
|

1. Введение в химию. Основные понятия химии (атомная, молекулярная, молярная и эквивалентная масса, моль, валентность, степень окисления). Значение химии в инженерном деле.
2. Сравнительная характеристика электролиза расплава и раствора соли.
Ответ:
Химия изучает свойства веществ и закономерности процессов, сопровождающихся изменениями их структуры и состава.
Объектами изучения в химии служат: атомы, ионы, молекулы, радикалы, растворы, коллоидные и дисперсные частицы, кристаллические, стеклообразные и полимерные системы, координационные и кластерные соединения.
Атом – наименьшая (неделимая химическим путем) часть элемента, сохраняющая все свойства, определенные зарядом ядра и электронной оболочкой. Составная часть вещества, содержащая одинаковые атомы, называется химическим элементом.
Атомный номер Z равен числу протонов в атомном ядре. В электронной оболочке электронейтрального атома содержится Zэлектронов.
Массовое число A равно сумме числа протонов Z и числа нейтронов N в атомном ядре; A = Z + N.
Нуклиды – атомы с определенным числом протонов и нейтронов.
Изотопы – атомы с одинаковым Z, но разными N.
Изобары – атомы с одинаковым A, но разными Z.
Изотоны – атомы с одинаковым N, но разными A.
Атомная масса – масса атома в атомных единицах массы (а. е. м.). За единицу а. е. м. принята 1/12 массы изотопа углерод-12.
Относительная атомная масса (безразмерная величина) она численно равна атомной массе элемента.
Относительная атомная масса элемента с учетом его изотопного состава равна – относительная атомная масса изотопа, – доля каждого из изотопов элемента в земной коре.
Способность атома присоединять или замещать определенное число других атомов называют валентностью. Мерой валентности считают число атомов водорода или кислорода, присоединенных к элементу (ЭHn, ЭOm), при условии, что водород одно-, а кислород двухвалентен.
Степень окисления – условный заряд атома элемента, полученный в предположении, что соединение состоит из ионов. Она может быть положительной, отрицательной, нулевой, дробной и обозначается арабской цифрой со знаком «+» или «–» в виде верхнего правого индекса символа элемента: Cl–I, Cl+VII, O–II, H+I, Mg+II, N–III, N+V, Cr+VI.
Моль – количество вещества, содержащее столько же частиц или структурных единиц (атомов, ионов, молекул, радикалов, электронов, эквивалентов и др.), сколько содержится атомов углерода в 12 г изотопа углерода-12 (число Авогадро)..
Молярная масса (M) – масса одного моля вещества, численно совпадающая с относительными массами атомов, ионов, молекул, радикалов и других частиц, выраженных в г•моль–1.
В инженерном деле: основания и фундаменты, механика грунтов, строительные конструкции – невозможны без химии. Огромной важности на железных дорогах вопросы коррозии и защиты металлов от коррозии.
Электролиз расплавленных солей. Рассмотрим Эл-з расплава Nа, при tплав≥8010C ионная кристаллическая решетка NaCl разрушается на ионы Na+ и Cl-. Поместим в этот расплав два химически инертных, не реагирующих с электролитом электрода, например, из графита (С). Это простейший случай электролиза, когда электролит состоит из одного вида катионов (Na+) и анионов (Cl-), никаких других частиц, могущих участвовать в эл-зе нет. С помощью внешнего источника тока электроны подводятся к одному из электродов, сообщая ему отрицательный заряд. Этот электрод явл-ся К(-), и на нем идет процесс восстановления: К(-)Na+ + 1 е = Na0. Под действием электрического поля ионы Cl- переносятся к А(+) и на нем окисляются А(+) 2Cl- - 2 е = Сl2. Электроны от анода переносятся к внешнему источнику тока. Суммирую К(-) и А(+), получим Ox-Red реакцию, протекающую в ходе электролиза: Na+ + Cl- → Na + ½ Cl2.
При электролизе расплава смеси солей NaCl и CuCl2 на К(-) возможно восстановление и Na+ и Cu2+, однако восстанавливаться будут ионы Cu2+: К(-) Cu2+ + 2 e = Cu0. Об этом свидетельствует положение Na и Cu в периодической системе и химические свойства этих элементов. Na – активный щелочной металл с низкой энергией ионизации, которая намного меньше энергии ионизации Cu до Cu2+. Следовательно окисленное состояние Na более типично. Чем для меди, и обратный процесс (восстановление Na+ до Na) требует больших энергетических затрат, чет восстановление Cu2+ до Cu.
На аноде идет процесс окисление Cl-: A(-)2Cl- - 2 е = Сl2.
Суммарно: NaCl + CuCl2 (Cu2+ + 3Cl- + Na+) → Cu0 + Сl2 + Na+
Или же Cu2+ + 2Cl- → Cu + Сl2.
Для определения наиболее вероятных реакций при электролизе расплавов нельзя пользоваться рядом стандартных потенциалов, т.к. это потенциалы Ox-Red процессов в водных растворах. Для расплавов есть свои электродные потенциалы. В ряде наиболее очевидных случаев для определения последовательности процессов при электролизе расплавов можно руководствоваться положением элементов в периодической таблице, сравнительной характеристикой химических свойств элементов и их ионов.
Электролиз растворов электролитов. Его отличие от электролиза расплавов состоит в том, что все ионы в водном растворе гидратированы, т. е. отличаются от аналогичных ионов в расплаве. И, кроме того, помимо самого вещества, в растворе присутствуют молекулы H2O и ионы H+ и O2-, как продукты диссоциации H2O, поэтому при рассмотрении реакций на электродах необходимо учитывать их возможное участие в электролизе.
Для определения наиболее вероятного процесса в ТД пользуются значениями ∆G0р-ции, что эквивалентно ЭДС Ox-Red реакции. Так для реакции H2 + ½O2 → H2O ∆G0р-ции = -237,3 кДж/моль.
E0 = (-∆G)/(nF), E0 = (237.3*1000)/(2*96500) = 1,23 В
Для того, чтобы заставить протекать процесс в обратном направлении (электролиз воды), необходимо напряжение внешнего источника больше 1,23 В. Такое минимальное напряжение, вызывающее электролиз, называется напряжение разложения (Uразл), или потенциал разложения (Eразл) соответствующего вещества. Чем меньше Uразл, тем легче осуществить электролиз вещества. Т. е. если имеются несколько веществ, то электролизу будет подвиргаться то вещество, которе имеет меньший потенциал разложения
Uразл = - E0 = Е0К – Е0А. Т. о., наиболее вероятным процессом на аноде будет реакция с минимальным электродным потенциалом, на катоде наиболее вероятна с максимальным электродным потенциалом.
Рассмотрим, например, электролиз раствора Na2SO4.
В электролизе способны участвовать частицы Na+, SO42-, H+, OH-, (из H2O), а также H2O (сами молекулы).
Возможные процессы на К(-):
* 2H2O + 2 е → H2 + 2OH- Е0 = -0,41 В U0 = -0.87 В
2H+ + 2 е → H2 малая диссоциация воды Е0 = -0,059*7 = -0,41В
Na+ + 1 e → Na Е0 = -2.71В
Вероятные процессы на А(+):
* 2H2O = O2 + 4 H+ + 4 e Е0 = +0.82 В U0 = 1.23 В
2SO42- = S2O8 + 2 e Е0 = +2.05 В
Т. о., при электролизе раствора Na2SO4 на К(-) выделяется водород, а на А(+) выделяется кислород, т.е. происходит только электролиз воды:
2H2O → 2H2 + О2.
* Рассмотрим также электролиз раствора CuCl2 (pH < 7, pH ~ 5)
К(-): 2H+ + 2 е → H2 Е0 = -0,3 В
* Cu2+ + 2 e → Cu Е0 = +0.34 В
А(+): 2H2O = O2 + 4 H+ + 4 e Е0 = +0,9 В! 1,23 - 0,3 = 0,93
2Cl- = Cl2 + 2 e Е0 = +1.36 В
Следовательно, в равновесных условиях на А(+) в первую очередь будет выделяться кислород. Однако важно учитывать не только ТД, но и кинетику процесса. Хотя выделение кислорода на аноде начинается раньше, скорость реакции окисления хлора в насыщенном растворе NаCl на некоторых анодах выше, чем скорость выделения кислорода. Кроме того, возможна кислородная поляризация, что повышает потенциал данной реакции.
Существует эмпирическое правило, согласно которому в первую очередь на аноде разряжаются анионы бескислородных кислот (кроме F-), затем вода, и только потом – анионы кислородосодержащих кислот.
Если потенциал металлического анода имеет более отрицательное значение, чем потенциалы других веществ или ионов, присутствующих в растворе, то происходит растворение металла. При этом протекает электролиз с растворимым анодом. Если потенциал металл или другого проводника, используемого в качестве анода, имеет более положительное значение, то идет электролиз с нерастворимым анодом. В качестве нерастворимых анодов применяют Au и платиновые металлы, PbO2, RuO4, С графит. Некоторые металлы практически не растворяются из-за высокой анодной поляризации, например Ni и Fe в щелочном растворе, Pb в H2SO4, Ti, Ta, нержавеющая сталь. Явление торможения анодного растворения металла из-за образования защитных слоев называется пассивностью металла.
Теперь уточним последовательность электродных процессов на катоде. Все окислители, которые восстанавливаются на К(-) можно разделить на три группы:
1. Ионы металлов, потенциалы которых существенно более отрицательны, чем потенциал водородного электрода (-0,41В, pH=7). В таких водных растворах на катоде выделяется только водород. Металлы могут быть получены только электролизом расплавов.
2. Ионы металлов, потенциалы которых более положительны, чем потенциал водородного электрода (Cu2+, Hg2+, Ag+, Au3+). При наличии этих ионов в растворе они разряжаются в первую очередь, т. е. на К(-) выделяется металл и разряд ионов H+ не происходит.
3. ионы, потенциал которых мало отличается от потенциала водородного электрода – Cd2+, Co2+, Ni2+ (с учетом изменения Е0Н2/Н+ вследствие различного pH солей этих металлов). В таких случаях на катоде протекают два параллельных процесса: выделение металла и выделение водорода.
Т. о., под действием электрического тока на электродах происходят процессы, называемые электролизом. Последовательность электродных процессов определяется значениями потенциалов этих процессов и поляризации при их протекании.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1916; Нарушение авторских прав?; Мы поможем в написании вашей работы!

