
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Экзаменационный билет № 27. Порядок протекания электролиза
|
|
|
|
Порядок протекания электролиза.
Существует эмпирическое правило, согласно которому в первую очередь на аноде разряжаются анионы бескислородных кислот (кроме F-), затем вода, и только потом – анионы кислородосодержащих кислот.
Если потенциал металлического анода имеет более отрицательное значение, чем потенциалы других веществ или ионов, присутствующих в растворе, то происходит растворение металла. При этом протекает электролиз с растворимым анодом. Если потенциал металл или другого проводника, используемого в качестве анода, имеет более положительное значение, то идет электролиз с нерастворимым анодом. В качестве нерастворимых анодов применяют Au и платиновые металлы, PbO2, RuO4, С графит. Некоторые металлы практически не растворяются из-за высокой анодной поляризации, например Ni и Fe в щелочном растворе, Pb в H2SO4, Ti, Ta, нержавеющая сталь. Явление торможения анодного растворения металла из-за образования защитных слоев называется пассивностью металла.
Теперь уточним последовательность электродных процессов на катоде. Все окислители, которые восстанавливаются на К(-) можно разделить на три группы:
1. Ионы металлов, потенциалы которых существенно более отрицательны, чем потенциал водородного электрода (-0,41В, pH=7). В таких водных растворах на катоде выделяется только водород. Металлы могут быть получены только электролизом расплавов.
2. Ионы металлов, потенциалы которых более положительны, чем потенциал водородного электрода (Cu2+, Hg2+, Ag+, Au3+). При наличии этих ионов в растворе они разряжаются в первую очередь, т. е. на К(-) выделяется металл и разряд ионов H+ не происходит.
3. ионы, потенциал которых мало отличается от потенциала водородного электрода – Cd2+, Co2+, Ni2+ (с учетом изменения Е0Н2/Н+ вследствие различного pH солей этих металлов). В таких случаях на катоде протекают два параллельных процесса: выделение металла и выделение водорода.
Т. о., под действием электрического тока на электродах происходят процессы, называемые электролизом. Последовательность электродных процессов определяется значениями потенциалов этих процессов и поляризации при их протекании.
1. Понятие об активированном комплексе. Энергия активации. Зависимость скорости химической реакции от температуры (правило Вант-Гоффа, уравнение Аррениуса).
2. Электрохимия. Электрический потенциал. Контактный и диффузионный потенциал.
Ответ:
Активированный комплекс,
группировка атомов в решающий момент элементарного акта химической реакции. Понятием об А. к. широко пользуются в теории скоростей химических реакций.
Протекание элементарного акта может быть рассмотрено на примере газовой бимолекулярной реакции образования йодистого водорода из водорода и паров иода:
H2+I2 = 2HI (1)
Как показывает квантовомеханическая теория, при сближении молекул H2 и I2 на расстояние, сравнимое с молекулярными размерами, они отталкиваются друг от друга с силой, быстро растущей при уменьшении расстояния. Подавляющее большинство столкновений молекул H2 и I2 в газовой смеси не приводит к реакции, потому что энергия теплового движения молекул оказывается недостаточной для преодоления отталкивания. У некоторой, весьма малой, доли молекул интенсивность теплового движения случайно много больше средней; этим создаётся возможность настолько тесного сближения молекул H2 и I2, что возникают новые химические связи между атомами Н и I, а существовавшие прежде химические связи Н—Н и I—I разрываются. Две образовавшиеся молекулы HI отталкиваются друг от друга и поэтому расходятся, чем завершается элементарный акт реакции. Переход от расположения связей 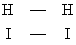 к расположению
к расположению  происходит не внезапно, а постепенно: по мере сближения молекул H2 и I2 связи Н—Н и I—I ослабевают и одновременно усиливаются связи Н—I. Отталкивание Н—Н от I—I сменяется отталкиванием Н—I от Н—I в момент, когда новое расположение связей начинает превалировать над старым. Таким образом, в ходе элементарного акта возникает конфигурация атомов, являющаяся критической в том смысле, что если она достигнута, то дальнейшее движение атомов происходит беспрепятственно, не требуя запаса энергии. Совокупность атомов в этой конфигурации и называется "активированным комплексом" (Г. Эйринг, США, 1935) или "переходным состоянием" (М. Г. Эванс и М. Поляни, Англия, 1935). Для обратной реакции
происходит не внезапно, а постепенно: по мере сближения молекул H2 и I2 связи Н—Н и I—I ослабевают и одновременно усиливаются связи Н—I. Отталкивание Н—Н от I—I сменяется отталкиванием Н—I от Н—I в момент, когда новое расположение связей начинает превалировать над старым. Таким образом, в ходе элементарного акта возникает конфигурация атомов, являющаяся критической в том смысле, что если она достигнута, то дальнейшее движение атомов происходит беспрепятственно, не требуя запаса энергии. Совокупность атомов в этой конфигурации и называется "активированным комплексом" (Г. Эйринг, США, 1935) или "переходным состоянием" (М. Г. Эванс и М. Поляни, Англия, 1935). Для обратной реакции
2HI = H2+I2 (2)
расположение атомов в А. к. будет таким же, как и для прямой реакции (1), но направления движения атомов в активированных комплексах реакций (1) и (2) взаимно противоположны.
За время t в единице объёма происходит с+ актов прямой реакции. Т. к. скорость прямой реакции r +. есть число соответствующих актов реакции в единице объёма в единицу времени, то
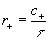 (3)
(3)
Величины с+ и t вычисляются методами статистической механики, при этом используют ряд упрощающих предположений, из которых главным является допущение, что протекание реакции не нарушает статистически равновесное распределение молекул по состояниям.
Уравнение (3) выражает основную идею теоретической трактовки скоростей реакций на основе концепции А. к. Оно не только позволяет судить о зависимости скорости реакции от концентраций веществ — участников реакции, от температуры и др. факторов, но устанавливает абсолютное значение скорости. Поэтому метод А. к. часто называют теорией абсолютных скоростей реакций. В некоторых сравнительно немногочисленных реакциях перестройка химических связей происходит затрудненно, так что достижение конфигурации А. к. ещё не гарантирует осуществление акта реакции. Чтобы учесть существование таких реакций, называемых неадиабатными, в правую часть равенства (3) вводят добавочный множитель, "коэффициент прохождения" или "трансмиссионный коэффициент"; в случае неадиабатных реакций он много меньше единицы.
Исходные понятия метода А. к. были разъяснены выше на примере гомогенной газовой реакции, но метод применяют и к скоростям реакций в растворах, гетерогенно-каталитических реакций и вообще к вычислению скоростей во всех случаях, когда превращение связано с необходимостью случайного концентрирования энергии теплового движения в количестве, значительно превышающем среднюю энергию молекул при данной температуре.
Сопоставление теории абсолютных скоростей реакций с опытными данными, как и теоретический анализ её предпосылок, показывает, что эта теория, будучи не вполне точной, вместе с тем является удачным приближением, ценным своей простотой.
Энергия активации в элементарных реакциях, минимальная энергия реагентов (атомов, молекул и др. частиц), достаточная для того, чтобы они вступили в химическую реакцию, т. е. для преодоления барьера на поверхности потенциальной энергии, отделяющего реагенты от продуктов реакции.
Правило Вант-Гоффа – при увеличении температуры на 10 °С скорость реакции увеличивается в 2-4 раза.

|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 505; Нарушение авторских прав?; Мы поможем в написании вашей работы!