
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Экзаменационный билет № 25. Энергия, сосредоточенная на границе раздела фаз, избыточная по сравнению с энергией в объеме
|
|
|
|
ПОВЕРХНОСТНАЯ ЭНЕРГИЯ
энергия, сосредоточенная на границе раздела фаз, избыточная по сравнению с энергией в объеме
Поверхностная энергия связана с межмолекулярным взаимодействием, т.к. состояние частиц (атомов, молекул) на границе раздела фаз отличается от состояния в объеме фаз вследствие нескомпен-сированности силовых полей частиц на пов-сти раздела.
Обычно, говоря о поверхностной энергии, имеют в виду уд. свободную поверхностную энергию s. С ростом т-ры вдали от критич. точки s линейно уменых ается, тогда как e практически от т-ры не зависит. При приближении к критич. точке различие в св-вах контактирующих фаз сглаживается и поверхностная энергия обращается в нуль
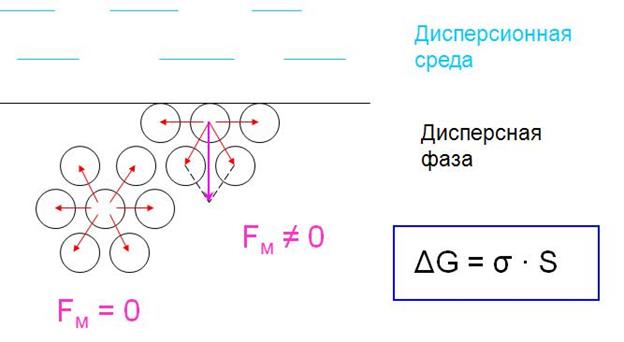
ΔG – свободная поверхностная энергия (энергия Гиббса образования поверхности, Дж)
S – площадь поверхности раздела фаз (м2)
σ – удельная поверхностная энергия (Дж/м2)
1. Свободная энергия Гиббса как определяющий критерий направленности химических процессов. Свободная энергия Гельмгольца. Связь термодинамических функций.
2. Понятие об адсорбции. Поверхностно-активные вещества.
Ответ:
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным TΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж):
ΔG = ΔH – TΔS
При ΔG < 0 реакция термодинамически разрешена и система стремится к достижению условия ΔG = 0, при котором наступает равновесное состояние обратимого процесса; ΔG > 0 указывает на то, что процесс термодинамически запрещен.
Записав уравнение в виде ΔH = ΔG + TΔS, получим, что энтальпия реакции включает свободную энергию Гиббса и «несвободную» энергию ΔS · T. Энергия Гиббса, представляющая собой убыль изобарного (P = const) потенциала, равна максимальной полезной работе. Уменьшаясь с течением химического процесса, ΔG достигает минимума в момент равновесия (ΔG = 0). Второе слагаемое ΔS · T(энтропийный фактор) представляет ту часть энергии системы, которая при данной температуре не может быть превращена в работу. Эта связанная энергия способна лишь рассеиваться в окружающую среду в виде тепла (рост хаотичности системы).
Итак, в химических процессах одновременно изменяются энергетический запас системы (энтальпийный фактор) и степень ее беспорядка (энтропийный фактор, не совершающая работу энергия).
Анализ уравнения (4.2) позволяет установить, какой из факторов, составляющих энергию Гиббса, ответственен за направление протекания химической реакции, энтальпийный (ΔH) или энтропийный (ΔS · T).
- Если ΔH < 0 и ΔS > 0, то всегда ΔG < 0 и реакция возможна при любой температуре.
- Если ΔH > 0 и ΔS < 0, то всегда ΔG > 0, и реакция с поглощением теплоты и уменьшением энтропии невозможна ни при каких условиях.
- В остальных случаях (ΔH < 0, ΔS < 0 и ΔH > 0, ΔS > 0) знак ΔG зависит от соотношения ΔH и TΔS. Реакция возможна, если она сопровождается уменьшением изобарного потенциала; при комнатной температуре, когда значение T невелико, значение TΔS также невелико, и обычно изменение энтальпии больше TΔS. Поэтому большинство реакций, протекающих при комнатной температуре, экзотермичны. Чем выше температура, тем больше TΔS, и даже эндотермические реакции становятся осуществляемыми.
| 1. | ΔH < 0 ΔS > 0 ΔG < 0 | C2H5–O–C2H5 + 6O2 = 4CO2 + 5H2O (реакция возможна при любой температуре) |
| 2. | ΔH > 0 ΔS < 0 ΔG > 0 | реакция невозможна |
| 3. | ΔH < 0 ΔS < 0 ΔG > 0, ΔG < 0 | N2 + 3H2 = 2NH3 (возможна при низкой температуре) |
| 4. | ΔH > 0 ΔS > 0 ΔG > 0, ΔG < 0 | N2O4(г) = 2NO2(г) (возможна при высокой температуре). |
Для оценки знака ΔG реакции важно знать величины ΔH и ΔS наиболее типичных процессов. ΔH образования сложных веществ и ΔH реакции лежат в пределах 80–800 кДж∙. Энтальпия реакции сгорания всегда отрицательна и составляет тысячи кДж∙. Энтальпии фазовых переходов обычно меньше энтальпий образования и химической реакции
Зависимость ΔH от температуры выражается соотношением ΔHT = ΔH° + ΔCp · ΔT, где ΔCp – изменение теплоемкости системы. Если в интервале температур 298 К – Т реагенты не претерпевают фазовых превращений, то ΔCp = 0, и для расчетов можно пользоваться значениями ΔH°.
Энтропия индивидуальных веществ всегда больше нуля и составляет от десятков до сотен Дж∙моль–1K–1. Знак ΔG определяет направление реального процесса. Однако для оценки осуществимости процесса обычно пользуются значениями стандартной энергии Гиббса ΔG°. Величина ΔG° не может использоваться в качестве критерия вероятности в эндотермических процессах со значительным возрастанием энтропии (фазовые переходы, реакции термического разложнения с образованием газообразных веществ и др.). Такие процессы могут быть осуществлены за счет энтропийного фактора при условии 
Свободная энергия Гельмгольца (или просто свободная энергия) —термодинамический потенциал, убыль которого в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами.
Адсорбцией называют самопроизвольное концентрирование вещества (молекул, ионов) на границе раздела фаз. Она определяется как избыток массы вещества на единице поверхности раздела. Адсорбция может быть вызвана действием межмолекулярных сил (физическая адсорбция) или действием сил химического сродства (химическая адсорбция, хемосоpбция). Хемосорбированное вещество прочно удерживается поверхностью, образуя химическое соединение с материалом поверхности.
Вещества, адсорбция которых приводит к снижению свободной поверхностной энергии на границе раздела фаз, называют поверхностно-активными. Молекулы этих веществ содержат полярные (-ОН, -СООН, - NH2, -ОNа., - SОзNа, -(О-СН2-GН2)n-он) и неполярные (длинные углеводородные, кремнийорганические
и фторуглеродные радикалы) группы. Благодаря дифильному строению поверхностно-активные вещества оказываются родственными обеим контактирующим фазам: полярная группа обусловливает сродство к полярной фазе (воде), а углеродная цепь - к неполярной фазе. Их молекулы ориентируются на гpаницe контактирующих фаз, создавая переходный слой, выравнивающий полярности обеих фаз. С помощью поверхностно-активных веществ можно управлять свойствами поверхности твердого материала, в частности, способностью его смачиваться водой. Первоначально хорошо смачивающаяся ВОДОЙ (гидрофильная) поверхность будет плохо смачиваемой (гидрофобной) после обработки ее раствором или парами поверхностно-активного вещества, если
в адсорбционном слоe молекулы поверхностно-активного вещества ориентированы неполярной группой наружу. Эффект гидрофобизации проявляется наиболее сильно в случае хемосорбции поверхностно-активного вещества. Гидрофобизация материалов широко применяется в технике и в строительном деле. Например, с целью увеличения срока хранения цемента без потери активности в цементный клинкер при помоле добавляют жирные кислоты, мылонафт, окисленный петролатум в количестве 0,06 - 0,З%. Гидрофобный цемент менее гигроскопичен, чем обычный. Объемная и поверхностная гидрофобизация бетона кремнийорганическими препаратами увеличивает долговечность изделий, снижает капиллярный подсос влаги и фильтруемость воды через бетон.
Адсорбция поверхностно-активных веществ и снижение свободной поверхностной энергии облегчают процессы образования новых поверхностей при диспергировании жидкостей и твердых тел (эффект Ребиндера). Молекулы этих веществ помогают развитию микротрещин в твердых телах. Проникал в устья щелей, они раздвигают их или препятствуют полному залечиванию. Таким об разом, с помощью поверхностно-активных веществ можно снизить энергозатраты на обработку металлов, измельчение цементного клинкера и пигментов, бурение скважин.
Твердые материалы, поверхность которых сложена из ионов или полярных молекул, способны адсорбировать ионы. Часто адсорбция одного иона сопровождается десорбцией другого в эквивалентном количестве, т.е. имеет место ионообменная адсорбция. Ионный обмен находит большое техническое применение и играет огромную роль в процессах, протекающих в почвах и грунтах. В почве ионообменными свойствами обладает высокодисперсная смесь алюмосиликатов и органоминеральных соединений ("поглощающий комплекс"), которая поглощает катионы калия, выделяя эквивалентные количества других. Минералы, составляющие грунты, и особенно глинистые, обменивают катионы натрия, калия, кальция, магния, ионы водорода.
Важно отметить, что состав обменных катионов существенно влияет на строительные свойства глинистых грунтов. Глинистые грунты, насыщенные ионами натрия, сильно набухают в воде и сжимаются под нагрузкой, почти водонепроницаемы, обладают повышенной мягкостью и пластичностью. Они легко "распускаются" в воде (пептизируются), иногда проявляют тиксотропность. Глинистые грунты, насыщенные ионами кальция в меньшей степени тиксотpoпны
и пластичны, меньше удерживают влагу и более водонепроницаемы. Следовательно, с помощью обмена можно управлять свойствами грунтов. Ионный обмен неизбежно происходит при засолении грунтов хлоридами натрия и кальция с целью предохранения их от промерзания или освобождения от снега и льда. Инженеру, планирующему подобную операцию, следует подумать о возможных последствиях ее.
Оглавление:
Билет №26
Билет №27
Билет №28
Билет №29
Билет №30
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1221; Нарушение авторских прав?; Мы поможем в написании вашей работы!