
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры веществ с ковалентной связью
|
|
|
|
Простой ковалентной связью соединены атомы в молекулах простых газов (Н2, Сl2 и др.) и соединений (Н2О, NH3, CH4, СО2, НСl и др.). Соединения с донорно-акцепторной связью — катион аммония NH4+, тетрафторборат aнион BF4− и др. Соединения с семиполярной связью — закись азота N2O, O−-PCl3+.
Кристаллы с ковалентной связью диэлектрики или полупроводники. Типичными примерами атомных кристаллов (атомы в которых соединены между собой ковалентными (атомными) связями могут служить алмаз, германий и кремний.
Единственным известным человеку веществом с примером ковалентной связи между металлом и углеродом является цианокобаламин, известный как витамин B12.
ВАЛЕНТНЫХ СВЯЗЕЙ МЕТОД (метод валентных схем), метод приближенного решения электронного ур-ния Шрёдингера для многоэлектронных молекулярных систем. Основан на представлениях о двухцентровых хим. связях между атомами в молекуле, образуемых двумя электронами. Эти представления являются обобщением на многоатомные молекулы приближения Гайтлера - Лондона, позволившего впервые с помощью квантовомех. методов объяснить хим. связь в молекуле Н2.
Осн. физ. идея В. с. м. состоит в том, что волновая ф-ция молекулы выражается через волновые ф-ции составляющих ее атомов. Образование хим. связи рассматривается как результат спаривания спинов своб. электронов атомов. Тем самым В. с. м. дает обоснование одному из осн. положений теории валентности: валентность нейтрального атома равна числу своб. электронов в его валентной оболочке. Каждому валентному штриху, соединяющему атомы А и В в структурной ф-ле молекулы, отвечает двухэлектронная ф-ция валентной связи ХАВ(1,2), к-рая представляется в виде произведения двух волновых ф-ций: пространственной Ф(1,2), симметричной относительно перестановки координат электронов, и спиновой 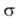 (1,2), антисимметричной относительно такой перестановки и описывающей систему двух электронов с противоположными спинами; цифры 1 и 2 в этих обозначениях указывают пространств. координаты или спиновые переменные первого и второго электронов либо те и другие одновременно. Следовательно,
(1,2), антисимметричной относительно такой перестановки и описывающей систему двух электронов с противоположными спинами; цифры 1 и 2 в этих обозначениях указывают пространств. координаты или спиновые переменные первого и второго электронов либо те и другие одновременно. Следовательно,
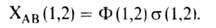
Для простейшей молекулы Н2 ф-цию Ф(1,2) строят из 1s-орбиталей атомов Н, обозначаемых для разных ядер как  и
и  , а ф-цию
, а ф-цию  (1,2) - из одноэлектронных спиновых ф-ций
(1,2) - из одноэлектронных спиновых ф-ций 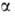 и
и 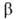 (спин-функций), описывающих состояния электронов с противоположно направленными спинами:
(спин-функций), описывающих состояния электронов с противоположно направленными спинами:
21. Кратность связи. Явления гибридизации химических связей. Примеры.
КРАТНОСТЬ СВЯЗИ - число электронных пар, обобществлённых двумя соседними атомами молекулы в результате ковалентной химической связи. Так, в молекуле этана Н3С-СН3 связь С-С одинарная, К. с. равна единице (одна общая пара электронов); в молекуле этилена Н2С = СН2 связь С = С двойная, К. с. равна двум (две - пары обобществлённых электронов); в молекуле ацетилена НС  СН тройная связь с тремя обобществлёнными парами электронов. Чем выше К. с., тем, как правило, меньше её длина и выше прочность. Ср. длина связи С-С в органич. соединениях 0,154 нм, С=С - 0,133 нм и С
СН тройная связь с тремя обобществлёнными парами электронов. Чем выше К. с., тем, как правило, меньше её длина и выше прочность. Ср. длина связи С-С в органич. соединениях 0,154 нм, С=С - 0,133 нм и С  С - 0,121 нм. Прочность связи соответственно выше у связи С
С - 0,121 нм. Прочность связи соответственно выше у связи С  С.
С.
К. с. не всегда выражается целым числом. Так, в молекуле бензола С6Н6 все связи углерод=углерод одинаковы и длины их равны 0,140 нм. Считается, что К. с. С-С в молекуле бензола равна 1,5. В металлоор-ганич. и комплексных соединениях К. с. выражается дробным числом, а иногда и вовсе не поддаётся однозначному определению
Гибридизация орбиталей — концепция смешения разных, но близких по энергии орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по энергии и форме. Гибридизация атомных орбиталей происходит при возникновении ковалентной связи между атомами. Гибридизация орбиталей очень полезна при объяснении формы молекулярных орбиталей и является интегральной частью теории валентных связей.
Теория гибридизации была предложена американским химиком Лайнусом Полингом для объяснения структуры таких молекул как метан. Исторически применялась только для простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей не является строго количественной, например она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул как вода. Поэтому в настоящее время используется в основном в педагогических целях и в синтетической органической химии.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1752; Нарушение авторских прав?; Мы поможем в написании вашей работы!