
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Sp-гибридизация. Происходит при смешивании одной s- и двух p-орбиталей
|
|
|
|
Sp2-гибридизация
Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов
22. Межмолекулярное взаимодействие. Водородная связь.
Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами или атомами. Впервые были учтены Я. Д. Ван-дер-Ваальсом в 1873 году. Учёт межмолекулярных сил необходим для объяснения свойств реальных газов и жидкостей.
МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ, взаимод. молекул между собой, не приводящее к разрыву или образованию новых хим. связей. Межмолекулярное взаимодействие определяет отличие реальных газов от идеальных, существование жидкостей и мол. кристаллов. От межмолекулярного взаимодействия зависят мн. структурные, спектральные, термодинамич., теплофиз. и др. св-ва в-в. Появление понятия межмолекулярного взаимодействия связано с именем Й. Д. Ван-дер-Ваальса, к-рый для объяснения св-в реальных газов и жидкостей предложил в 1873 ур-ние состояния, учитывающее межмолекулярное взаимодействие (см. Ван-дер-Ваальса уравнение). Поэтому силы межмолекулярного взаимодействия часто называют ван-дер-ваальсовыми.
Виды межмолекулярного взаимодействия. Основу межмолекулярного взаимодействия составляют кулоновские силы взаимод. между электронами и ядрами одной молекулы и ядрами иэлектронами другой. В экспериментально определяемых св-вах в-ва проявляется усредненное взаимод., к-рое зависит от расстояния R между молекулами, их взаимной ориентации, строения и физ. характеристик (ди-польного момента, поляризуемости и др.). При больших R, значительно превосходящих линейные размеры l самих молекул, вследствие чего электронные оболочки молекулне перекрываются, силы межмолекулярных взаимодействий можно достаточно обоснованно подразделить на три вида-электростатические, поляризационные (индукционные) и дисперсионные. Электростатич. силы иногда называют ориентационными, однако это неточно, поскольку взаимная ориентация молекул может обусловливаться также и поляризац. силами, если молекулыанизотропны.
При малых расстояниях между молекулами (R ~ l) различать отдельные виды межмолекулярных взаимодействий можно лишь приближенно, при этом, помимо названных трех видов, выделяют еще два, связанные с перекрыванием электронных оболочек, - обменное взаимодействие и взаимодействия, обязанные переносу электронного заряда. Несмотря на нек-рую условность, такое делениев каждом конкретном случае позволяет объяснять природу межмолекулярного взаимодействия и рассчитать его энергию.
Э н е р г и я э л е к т р о с т а т и ч е с к о г о в з а и м о д е й с т в и я Vэл-ст представляет собой энергию кулоновского взаимод., вычисленную в предположении, что распределение зарядовой плотности отвечает изолир. молекулам (R =  ). В общем случае электрич. потенциал вокруг молекулы изменяется не только по абс. величине, но и по знаку. Если взаимная ориентация двухмолекул такова, что область положит. потенциала одной из них приблизительно совпадает с областью, в к-рой локализован отрицат. заряд другой, то Vэл-ст < 0, т. е. электростатич. взаимод.молекул ведет к их притяжению. При R>>l энергия Vэл-ст становится равной сумме энергий взаимод. мультиполей (диполей, квадруполей и т. д.); для полярных молекул главный вклад дает обычнодиполь-дипольное взаимодействие. Его энергия Vдип-дип может иметь разный знак в зависимости от ориентации диполей. При ориентации молекул А и В, соответствующей минимуму энергии взаимод., Vдип-дип = — 2pApB/R3, где pА и рB - дипольные моменты молекул А и В соответственно. В газовой фазе, где молекулы почти свободно вращаются, более вероятны такие их взаимные ориентации, к-рые отвечают притяжению диполей. При этом средняя энергия взаимод. равна:
). В общем случае электрич. потенциал вокруг молекулы изменяется не только по абс. величине, но и по знаку. Если взаимная ориентация двухмолекул такова, что область положит. потенциала одной из них приблизительно совпадает с областью, в к-рой локализован отрицат. заряд другой, то Vэл-ст < 0, т. е. электростатич. взаимод.молекул ведет к их притяжению. При R>>l энергия Vэл-ст становится равной сумме энергий взаимод. мультиполей (диполей, квадруполей и т. д.); для полярных молекул главный вклад дает обычнодиполь-дипольное взаимодействие. Его энергия Vдип-дип может иметь разный знак в зависимости от ориентации диполей. При ориентации молекул А и В, соответствующей минимуму энергии взаимод., Vдип-дип = — 2pApB/R3, где pА и рB - дипольные моменты молекул А и В соответственно. В газовой фазе, где молекулы почти свободно вращаются, более вероятны такие их взаимные ориентации, к-рые отвечают притяжению диполей. При этом средняя энергия взаимод. равна:

где Т-абс. т-ра, k-постоянная Больцмана. При фиксированной ориентации молекул, напр. в твердом теле, Vдип-дип слабо зависит от Т и изменяется пропорционально R-3. Есливзаимодействующие молекулы обладают квадрупольными или более высокого порядка электрич. моментами, в выражение для Vэл-ст входят также слагаемые, отвечающие взаимод. этих мультиполей. По этой причине, в частности, энергетически наиб. выгодная ориентация молекул может отличаться от оптимальной ориентации их дипольных моментов.
П о л я р и з а ц и о н н о е в з а и м о д е й с т в и е обусловлено деформацией электронной оболочки одной молекулы под влиянием электрич. поля другой, что всегда приводит к понижению энергии (притяжению молекул). При больших расстояниях между нейтральными молекулами главный вклад в поляризац. энергию Vпол дает взаимод. постоянного диполя полярной молекулы с индуцированным диполем другой. Поэтому это взаимод. иногда называют индукционным. Согласно ф-ле Дебая,
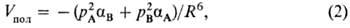
где aА и aB- средние статич. поляризуемости молекул А и В соответственно. Если поляризуемости молекул анизотропны, то в выражении для Vпол появляются дополнит. члены, зависящие от взаимной ориентации молекул.
Межмолекулярное взаимодействие, связанное с переносом электронного заряда с одной молекулы на другую, близко по физ. смыслу к поляризац. межмолекулярному взаимодействию. Перенос заряда происходит при перекрывании электронных оболочек молекул, если их сродство к электрону различно. Перенос заряда можно наглядно рассматривать как "далеко зашедшую"поляризацию, однако энергия межмолекулярного взаимодействия, связанного с переносом заряда, |V|п.з по своему абс. значению существенно меньше | Vпол | и очень быстро (экспоненциально) стремится к нулю с увеличением R. Строго разделить вклады поляризации и переноса заряда в энергию межмолекулярного взаимодействия затруднительно, поэтому часто вычисляют суммарную величину, обозначаемую просто Vпол.
Дисперсионное межмолекулярное взаимодействие определяется корреляцией движения электронов двух взаимодействующих молекул, в результате чего среднее расстояние между электронамиэтих молекул несколько увеличивается. Это приводит к уменьшению энергии их взаимодействия, т.е. к притяжению молекул. Дисперсионное взаимод. имеет универсальный характер: оно существует между любыми молекулами. Энергия дисперсионного взаимод. Vдисп двух атомов или сферически симметричных молекул при R>>l приближенно описывается ф-л о й Л о н д о н а:

где IА и IB-потенциалы ионизации молекул А и В соответственно. Для молекул иной формы зависимость Vдисп от R и от их физ. характеристик оказывается более сложной (подробнее см.Дисперсионное взаимодействие). При близких расстояниях (R ~ l) дисперсионное межмолекулярное взаимодействие усложняется и обычно наз. корреляционным. Его энергия V м.б. вычислена методами квантовой химии. При сверхдальних расстояниях между молекулами (порядка 100 нм) на их взаимод. начинает сказываться конечность скорости распространения электрич. сигнала (скорости света), в силу чего заряды взаимод. не мгновенно, а с нек-рым запаздыванием; Vдисп оказывается пропорциональным R-7.
Энергия о б м е н н о г о в з а и м о д е й с т в и я молекул Vобм обусловлена тем, что в соответствии с принципом Паули в одном и том же квантовом состоянии не могут находиться два электронас одинаковыми спинами. Вследствие этого электронная плотность в пространстве между молекулами при перекрывании их электронных оболочек уменьшается (подробнее см. Обменное взаимодействие).
Полная энергия межмолекулярного взаимодействия, или межмолекулярный потенциал, V приблизительно равняется сумме вкладов отдельных видов межмолекулярного взаимодействия:

При R >> l последний член обращается в нуль, а первые три можно вычислить по ф-лам (1)-(3). При малых расстояниях между молекулами эти ф-лы, строго говоря, не пригодны для количеств. определения V, однако во мн. случаях они дают правильную качеств. картину межмолекулярного взаимодействия. Если обе или одна из молекул имеет электрич. заряд, то ф-ла (4) остается в силе, однако каждое слагаемое изменится и будет отражать действие дополнит. заряда одной молекулы на другую.
При нек-ром расстоянии R = Re и подходящей взаимной ориентации молекул А и В силы притяжения становятся равными силам отталкивания, потенциал V(R)имеет минимум и система находится в равновесии. Если при этом глубина потенц. ямы больше нулевой энергии межмол. колебания, то молекулы образуют устойчивый комплекс (ассоциат), что подтверждается спектральными данными. Расчеты показывают, что в тех случаях, когда молекулы полярны (или имеют электрич. заряд), наибольший по абс. величине вклад в энергию притяжения при R  Reдает Vэл-ст. Величина Vобм того же порядка, но она приводит к отталкиванию молекул. Вклады Vпол и V дисп составляют при этом, как правило, от 20 до 40% суммарной энергии притяжения; Vдисп(Vкорр) играет существ. роль только для межмолекулярного взаимодействия неполярных или слабо полярных молекул (с малым дипольным моментом).
Reдает Vэл-ст. Величина Vобм того же порядка, но она приводит к отталкиванию молекул. Вклады Vпол и V дисп составляют при этом, как правило, от 20 до 40% суммарной энергии притяжения; Vдисп(Vкорр) играет существ. роль только для межмолекулярного взаимодействия неполярных или слабо полярных молекул (с малым дипольным моментом).
23. Металлическая связь. Электродные потенциалы. Уравнение Нернста.
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 603; Нарушение авторских прав?; Мы поможем в написании вашей работы!