
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приготовление рабочего раствора кислот и щелочей из концентрированных растворов
|
|
|
|
Сколько мл. концентрированного раствора азотной кислоты удельного веса 1,400 потребуется для приготовления 500 мл, 1н.раствора?
Решение: Рассчитываем вес кислоты по формуле (8):
 .
.
Находим по таблице процентное содержание НNO3 удельного веса 1,400 г/см3. Оно равно 66,97%
Далее расчет производится по пропорции:
100 г р-ра – 66,97 г HNO3
Х - 3,15 г HNO3 ;
Можно этот же расчет производить по формуле:
 , (9)
, (9)
где V( HNO3) – нужное количество мл. концентрированной кислоты, d- ее плотность, А – процентная концентрация кислоты, V- объем приготовляемого раствора, мл.
3. При разбавлении растворов меняется его объем и концентрация, но общее количество грамм- эквивалентов остается постоянным. Следовательно, при разбавлении можно использовать уравнение (5).
Например, до какого объема нужно разбавить 100мл 2н. Раствора HNO3, чтобы концентрация кислоты стала равной 0,4н.
Решение:
V1N1= V2N2
V10,4= 100*2
V1 = 500 мл.
Т.е. нужно к раствору прилить 400 мл. H2O
4. Смешивание растворов. Чтобы вычислить соотношения, в которых следует взять два раствора известных концентраций, пользуются правилом “креста”. По этому правилу в центре пишут ту концентрацию, которую требуется получить (в%).
У концов линий слева пишутся концентрации исходных растворов, большая- сверху, меньшая- снизу. У концов линий креста справа пишут разность между концентрациями исходных растворов и требуемого раствора (разность меньшей концентрации и требуемой – вверху). Эта разность показывает, сколько следует взять весовых частей раствора большей концентрации. Разность большей концентрации и требуемой записывается справа внизу и показывает, сколько нужно взять раствора меньшей концентрации.
Пример1. В каком соотношении следует смешать 80%-ный раствор HCI с 10%, чтобы получить 30%-ный раствор?
Решение: По правилу «креста» находим
80 
 20
20

 30 30-10=20
30 30-10=20
10 50 80-30=50
следовательно, надо взять 20 весовых частей 80%-го раствора и прибавить к нему 50 весовых частей 10%-го раствора.
Пример2. Какие количества 80%-го и 20%-го растворов HNO3
Нужно взять, чтобы приготовить 1500г. 40%-го раствора?
Решение: Находим по правилу «креста» соотношение весовых частей:
80  20
20


 |
40
20  40
40
Следовательно соотношение весовых частей g’А:g’B = 20: 40. Количество 80%-го раствора определяется из соотношения:
 ,
,
а количество 20%-го раствора можно найти из соотношения:
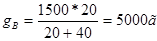
Пример3. Несколько иначе выглядит расчет разбавления или увеличения концентрации имеющегося раствора. Пусть требуется рассчитать, сколько 80%-ой серной кислоты надо добавить к 500г. 20%-ой кислоты, чтобы получить 60% раствор?
Решение: по правилу «креста»

 80 40
80 40

 60
60
20 20
т.е. на 20г. 20%-го раствора следует взять 40г. 80%-го раствора. Далее находим то количество 80%-ой кислоты, которое нужно добавить к 500г слабой кислоты, составив пропорцию:
20 - 40
500 - X
 .
.
Пример 4. При приготовлении определенных объемов растворов необходимо учитывать плотность, чтобы переводить объемные единицы измерений в весовые.
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 670; Нарушение авторских прав?; Мы поможем в написании вашей работы!