
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Генетические дефекты метаболизма фенилаланина и тирозина
|
|
|
|
Фенилкетонурия развивается как результат потери способности организма синтезировать фенилаланин-4-монооксигеназу, катализирующая превращение фенилаланина в тирозин. Характерной особенностью болезни является резкое замедление умственного развития ребенка, экстракция с мочой больших количеств фенилпировинаградной кислоты и фенилацетилглутамина, а также накопления в тканях фенилаланина.
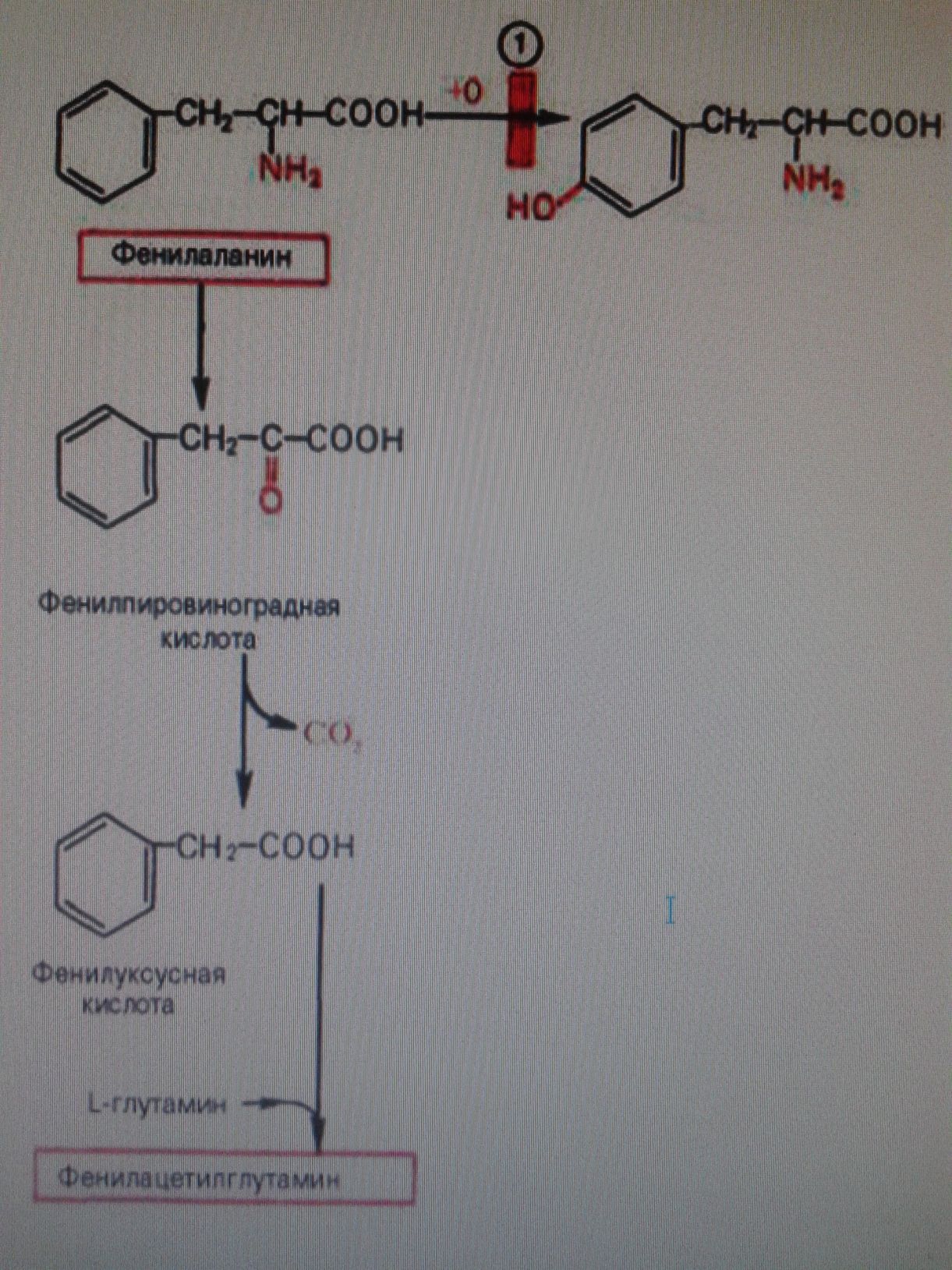
Развитие болезни можно предотвратить, если значительно снизить или исключить прием фенилаланина с пищей с самого рождения.
Альбинизм характеризуется врожденным отсутствием пигментов в коже, волосах и сетчатке. Метаболический дефект связан с потерей меланоцитами способности синтезировать тирозиназу – фермент, катализирующий окисление тирозина в диоксифенилаланин и диоксифенилаланинхинон, являющихся предшественниками меланина.
10.Переваривание белков в желудке. Пепсин, его строение и функция в процессе переваривания белка.
В желудке имеются все условия для переваривания белков. Во-первых в желудочном соке содержится активный фермент пепсин. Во-вторых, благодаря наличию в желудочном соке свободной соляной кислоты для действия пепсина создается оптимальная среда. Соляная кислота переводит неактивный пепсиноген в активный пепсин, создает оптимальную среду для действия пепсина, в присутствии соляной кислоты происходит набухание белков, происходит частичная денатурация, кроме того она ускоряет всасывание железа и оказывает бактерицидное действие. Пепсин вырабатывается в клетках слизистой оболочки желудка в неактивной форме – в виде пепсиногена, активатором которого является соляная кислота. Пепсин гидролизует преимущественно пептидные связи, образованные аминогруппами ароматических аминокислот. Он расщепляет практически все природные белки. Наибольший гидролитический эффект пепсин оказывает на денатурированные белки.
11. Синтез мочевины(схема). Гипераммонемия. 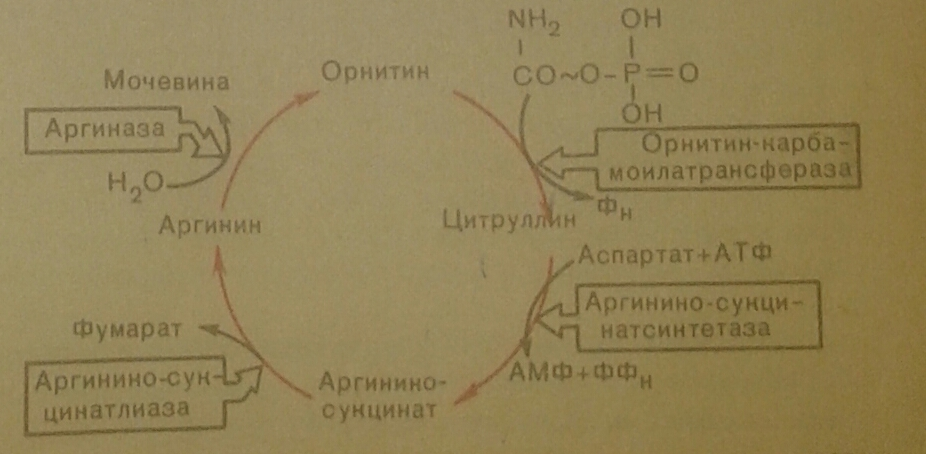
Гипераммонемия – это нарушение обмена веществ, проявляющиеся в недостаточности цикла ферментов мочевины, приводящее к отравлению организма аммиаком. Предельно допустимый уровень аммиака в крови 60 мкмоль/л. При повышении концентрации аммиака до предельных величин может наступить кома или смерть. При хронической гипераммонемии развивается умственная отсталость.

Основа лечения гипераммониемий сводится к ограничению белка в диете, это уже позволяет предотвратить многие нарушения мозговой деятельности.
ФЕРМЕНТЫ
1. Коферментные функции витаминов РР и В2
Витамин PP (ниацин) включает два соединения: никотиновую кислоту и ее амид. Открыт как фактор против пеллагры (отсюда PP), заболевания человека и животных, распространенного в XIX в.
Витамин жизненно необходим для клеточного метаболизма как катализатор окислительно-восстановительных процессов. Как и флавиновые коферменты, образующиеся из ниапина коферментные формы - никотинамида-дениндинуклеотид (НАД) и никотинамидадениндину-клеотидфосфат (НАДФ) (рис. 1), его фосфорилиро-ванные производные, участвуют в транспорте протонов и электронов.
Диапазон действия витамина чрезмерно широк. Он «вмешивается» в обмен белков, углеводов, липидов, обладает гипотензивным, антианемическим, антисклеротическим, сосудорасширяющим действием. С витамином PP связаны процессы обмена глюкозы, аминокислот, биосинтеза жирных кислот, простагландинов, стероидов. Витамин регулирует не только функции оксидоредук-ции, но и практически ферментативные реакции всех видов. Установлена возможность синтеза витамина из аминокислоты триптофана, который, таким образом, наряду с витамином PP является предшественником НАД (Ф)-коферментов. НАД восстановленный является субстратом, компонентом дыхательной цепи митохондрий с самым большим отрицательным потенциалом. Окисление восстановленного НАД сопровождается выделением энергии, кумулирующейся в виде макроэргической химической связи АТФ.
Клинические проявления авитаминоза PP (пеллагры) в основном представлены триадой — дерматит, диаррея, деменция. У больных наблюдаются поносы, бледность, сухость губ, специфический дерматит— поражение открытых для солнца частей тела, особенно лица, а также нарушения сознания — галлюцинации, бред, потеря памяти.
В настоящее время очевидно, что разнообразные физиологические эффекты действия витамина PP реализуются через взаимодействие его с гормонами гипофизарно-адреналовой системы и стероидными гормонами надпочечников.
Практически важное свойство никотиновой кислоты— способность расширять сосуды, влиять на микроциркуляцию крови, процессы свертываемости, очевидно, осуществляется путем активации системы кининов — биологически активных пептидов.
Находит применение и способность витамина PP направлять метаболизм в русло синтеза сукцината из липидов, активировать окисление липидов и снижать их содержание в крови. Это особенно важно при гипермобилизации жира из депо — атеросклерозе, выбросе кортикостероидов и др. В настоящее время
антилипемическое действие никотиновой кислоты и никотинамида доказано.
Много витамина PP или триптофана содержат следующие продукты: отруби злаков (особенно риса), дрожжи и продукты животного происхождения — печень, мясо, молоко
ниацин может синтезироваться в организме из аминокислоты триптофана. Теоретически 60 мг триптофана эквивалентны 1 мг никотиновой кислоты.
Структура витамина B2, как и тиамина, проявляет высокую специфичность: незначительные изменения могут вызвать снижение и даже потерю витаминных свойств или появление антивитаминных. Физиологическая роль витамина связана с его коферментной функцией. Ko-ферменты B2 — рибофлавинфосфат или флавинмоно-нуклеотид (ФМН) и его аденилированное производное флавинадениндинуклеотид (ФАД) (рис. 1), который синтезируется при взаимодействии ФМН с АТФ. В настоящее время известно несколько десятков ферментов, содержащих ФМН или ФАД и составляющих семейство флавиновых ферментов.
Именно кофермент, а точнее — изоаллоксазиновое кольцо рибофлавина, выполняет основную каталитическую функцию, присоединяя или отдавая два атома водорода. Таким образом, флавиновые ферменты—важнейшие участники процессов биологического окисления практически во всех клетках животных, чем и определяется влияние витамина на процессы роста и развития организма. В тканях витамин B2 содержится в виде коферментных форм (более 90 %), преимущественно ФАД. Свободный витамин обнаруживается в молоке, крови, моче, сетчатке глаза.
В активном центре ряда флавиновых ферментов обнаружены металлсодержащие производные рибофлавина — его комплексы с железом, медью, молибденом. Среди флавиновых ферментов имеются энзимы, переносящие водород от субстратов (различных веществ) на кислород, называемые оксида-зами и восстанавливающие другие акцепторы протонов и электронов в отсутствие кислорода — дегид-рогеназы. Несомненно, центральная «фигура» — фермент сукцинатдегидрогеназа, окисляющий янтарную кислоту и являющийся звеном цикла Кребса. Уникальная функция сукцинатдегидрогеназы заключается в том, что в условиях напряжения механизмов синтеза АТФ (гипоксия, различные стрессорные воздействия), когда другие окислительные процесы цикла угнетены, сукцинатдегидрогеназа активно пропускает поток протонов и электронов на дыхательную цепь, минуя НАД-зависимое звено. Это имеет огромный физиологический смысл в плане адаптации на уровне клетки.
Другой флавиновый фермент — глутатионредук-таза — поддерживает в клетке определенную концентрацию важнейшего тиолового соединения глутатио-на, постоянно регенерируя его из окисленной формы. Этим фермент регулирует окислительно-восстановительный статус клетки и участвует в детоксикации избытка окислителей. Глутатионредуктаза — важный компонент глутатионовой антиперекисной системы, фермент-антиоксидант, поэтому и витамин B2 относят к веществам, косвенно обладающим антиокси-дантными свойствами.
ФАД вместе с тиаминдифосфатом является компонентом пируват- и а-кетоглутаратдегидрогеназных комплексов. Флавиновые оксидазы катализируют окисление пуринов и образование мочевой кислоты (ксантиоксидаза), превращения адреналина и других биологически активных аминов (моноаминоксидаза).
Наконец, ФАД — компонент дыхательной цепи митохондрий, в которых окисление химических веществ завершается образованием воды и выделением энергии в виде АТФ.
Даже этот краткий перечень «заслуг» рибофлавина дает представление о нем как о важнейшем катализаторе окислительно-восстановительных процессов в клетке, чем и определяется картина витаминной недостаточности, для которой характерны такие общие поражения, как слабость, нарушения роста, поражения слизистых, заболевания глаз (конъюк-тивит, нарушение темновой адаптации, светобоязнь), анемия. Для недостаточности рибофлавина характерны сухость и трещины губ и особенно трещины в углах рта, сухой ярко-красный язык.
Источники витамина B2 для человека в основном те же, что и тиамина: мясо, печень, яичный желток, молоко, злаки, шпинат, капуста, картофель, дрожжи.
2. ФАД. Зависимые дегидрогеназы: сукцинатдегидрогеназы
Дыхательная цепь (ферменты тканевого дыхания) - это переносчики протонов и электронов от окисляемого субстрата на кислород. Окислитель - это соединение, способное принимать электроны. Такая способность количественно характеризуется окислительно-восстановительным потенциалом по отношению к стандартному водородному электроду, рН которого равен 7,0. Чем меньше потенциал соединения, тем сильнее его восстанавливающие свойства и наоборот.
Т. о. любое соединение может отдавать электроны только соединению с более высоким окислительно-восстановительным потенциалом. В дыхательной цепи каждое последующее звено имеет более высокий потенциал, чем предыдущее.
Дыхательная цепь состоит из:
НАД - зависимой дегидрогеназы;
ФАД- зависимой дегидрогеназы;
Убихинона (КоQ);
Цитохрмов b, c, a+a3.
НАД-зависимые дегидрогеназы. В качестве кофермента содержат НАД и НАДФ. Пиридиновое кольцо никотинамида способно присоединять электроны и протоны водорода.
ФАД и ФМН-зависимые дегидрогеназы содержат в качестве кофермента фосфорный эфир витамина В2 (ФАД).
Убихинон (КоQ) отнимает водород у флавопротеидов и превращается при этом в гидрохинон.
Цитохромы - белки хромопротеиды, способные присоединять электроны, благодаря наличию в своем составе в качестве простетических групп железопорфиринов. Они принимают электрон от вещества, являющегося немного боле сильным восстановителем, и передают его более сильному окислителю. Атом железа связан с атомом азота имидазольного кольца аминоксилоты гистидина с одной стороны от плоскости порфиринового цикла, а с другой стороны с атомом серы метионина. Поэтому потенциальная способность атома железа в цитохромах к связыванию кислорода подавлена.
В цитохроме с порфириновая плоскость ковалентно связана с белком через два остатка цистеина, а в цитохромах b и а, она ковалентно не связано с белком.
В цитохроме а+а3 (цитохромоксидазе) вместо протопорфирина содержатся порфирин А, который отличатся рядом структурных особенностей. Пятое координационное положение железа занято аминогруппой, принадлежащей остатку аминосахара, входящего в состав самого белка.
В отличии от гема гемолгобина атом железа в цитохромах может обратимо переходить из двух в трехвалентное состояние это обеспечивает транспорт электронов (См. подробнее приложение 1 "Атомная и электронная структура гемопротеинов ").
Вопрос 3
Ферментативный ингибитор — вещество, замедляющее протекание ферментативной реакции. Различают обратимые и необратимые ингибиторы (см. ниже).
Изучение ингибирования ферментов играет важную роль в создании лекарств, в изучении механизма действия и структуры ферментов
Обратимое ингибирование
Конкурентное ингибированиеКонкурентный ингибитор обычно структурно схож с субстратом, однако фермент не способен катализировать реакцию в присутствии ингибитора из-за отсутствия у последнего необходимых функциональных групп.
Схема конкурентного ингибирования и уравнение Михаэлиса-Ментен для него выглядят следующим образом:
 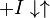 
| 
|
Видно, что при конкурентном ингибировании максимальная скорость реакции Vmax не меняется, а кажущаяся константа Михаэлиса увеличивается в (1 + [ I ]/ Ki) раз. Поэтому в двойных обратных координатах Лайнуивера-Берка (зависимость 1/ v 0 от 1/[ S ]) при разных концентрациях ингибитора получают семейство прямых с различным наклоном, пересекающихся в одной точке на оси ординат.
Константу ингибирования Ki обычно определяют так: проводят ряд измерений кажущейся константы Михаэлиса при различных концентрациях ингибитора, затем строят зависимость этой величины от концентрации ингибитора. Тангенс угла наклона полученной прямой равен Km / Ki.
Неконкурентное ингибирование
Неконкурентный ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу с одинаковой эффективностью. Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.
Схема и уравнение Михаэлиса-Ментен в случае неконкурентного ингибирования:
  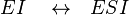
| 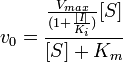
|
При неконкурентном ингибировании константа Михаэлиса не изменяется, а максимальная скорость реакции уменьшается в (1 + [ I ]/ Ki) раз. Поэтому в двойных обратных координатах семейство прямых, отвечающих разным концентрациям ингибитора, пересекается в одной точке на оси абсцисс.
Бесконкурентное ингибирование
При бесконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом. Субстрат, связываясь с ферментом, изменяет его конформацию, что делает возможным связывание с ингибитором. Ингибитор, в свою очередь, так меняет конформацию фермента, что катализ становится невозможным.
Схема и уравнение Михаэлиса-Ментен в случае бесконкурентного ингибирования:

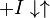
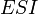
| 
|
Максимальная скорость реакции и кажущаяся константа Михаэлиса уменьшаются в одинаковое число раз. Поэтому в двойных обратных координатах для разных концентраций ингибитора получаем семейство параллельных прямых.
Ингибирование субстратом
Ингибирование субстратом — частный случай бесконкурентного ингибирования, когда две молекулы субстрата связываются с ферментом, что препятствует образованию продукта.
Схема и уравнение Михаэлиса-Ментен в случае ингибирования субстратом:

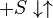
| 
|
Необратимое инги бирование
Формирование стабильного комплекса ингибитора с ферментом, ведущее к его необратимой инактивации. Случай необратимого ингибирования можно обнаружить по тому признаку, что при разбавлении раствора не происходит повышения удельной активности фермента, как в случае обратимого ингибирования
Аллостерическое ингибирование
Аллостерические ингибиторы связываются с отдельными участками фермента вне активного центра. Такое связывание влечет за собой конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности. Аллостерические эффекты встречаются практически только в случае олигомерных ферментов. Кинетику таких систем нельзя описать с помощью простой модели Михаэлиса-Ментен.
4 вопросВторичные энзимопатии
Вторичные энзимопатии являются следствием тех или иных патологических процессов, сопровождающихся нарушением активности ферментов. Они наблюдаются при многих заболеваниях. Так например, причиной развития вторичной лактазной недостаточности могут являться: кишечные инфекции вирусной и бактериальной этиологии, паразитарные заболевания (лямблиоз и др.), синдром короткой кишки (пострезекционный), целиакия, токсическое и лекарственное поражения кишечника (на фоне лучевой и химиотерапии, антибиотикотерапии).
Одним из вариантов вторичных энзимопатий являются алиментарные энзимопатии – патологические состояния, обусловленные стойкими нарушениями активности ферментов в связи с характером питания. Алиментарные энзимопатии могут быть обусловлены длительным дефицитом белка в питании (например при квашиоркоре), нарушением биосинтеза коферментов при витаминной недостаточности, угнетением синтеза металлоферментов при низком содержании в рационе соответствующих минеральных веществ. Кроме того, они могут возникать при несбалансированном питании в целом. К развитию алиментарных энзимопатий может приводить также нарушение поступления пищевых веществ из желудочно-кишечного тракта в кровь при длительных поносах, атрофии или поражении слизистой оболочки кишечника и др. К алиментарным энзимопатиям относят и так называемые токсические энзимопатии, связанные с угнетением активности или биосинтеза отдельных ферментов различными естественными компонентами пищевых продуктов (ингибиторы протеолитических ферментов, антивитамины и др.) или чужеродными веществами (например пестицидами), содержащимися в них.
Клинические проявления приобретенных энзимопатий зависят от вида фермента, функция которого нарушена и характеризуется нарушениями того или иного вида обмена веществ.
Энзимопатии углеводнго обмена
Галактоземия – возникает при нарушении обмена галактозы, обусловленном наследственным дефектом одного из трех ферментов, включающим галактозу в метаболизм глюкозы. Галактоземия, вызванная недостаточностью галактозо-1-фосфатуридилилтрансферазы (ГАЛТ) наиболее хорошо изучена. Это заболевание проявляется очень рано и особенно опасно для детей, так как основным источником углеводов для них служит материнское молоко, содержащее лактозу. Ранние симптомы дефекта ГАЛТ: рвота, диарея, дегидратация, уменьшение массы тела, желтуха, гепатомегалия, катаракта, задержка психического развития. Лабораторные исследования при этом выявляют галактоземию, галактозурию, галактозо-1-фосфатемию, тенденцию к гипогликемии.
При дефекте фермента галактокиназы у пациентов отмечается галактоземия, галактозурия, катаракта. Гораздо реже причиной возникновения галактоземии является дефект уридилфосфат-4-эпимеразы, при котором не отмечается тяжелых клинических проявлений.
При диагностике галактоземии исследуют мочу на содержание галактозы, собранную после нескольких кормлений молоком. При обнаружении у ребенка катаракты его обследуют на недостаточность галактокиназы и ГАЛТ.
^ Недостаточность дисахаридаз. Дисахаридазы локализованы в щеточной каемке клеток слизистой тонкого кишечника и участвуют в расщеплении дисахаридов на моносахариды, что является необходимым условияем их всасывания. Дисахаридазы подразделяются на α-гликозидазы (изомальтаза, сахараза, мальтаза) и β-гликозидазы (лактаза, β-галактозидаза).
К этой группе нарушений относится отсутствие активности сахаразы и изомальтазы. Дисахариды не расщепляются и не могут быть утилизированы. Они осмотически активны, связывают воду в просвете кишечника и вызывают диарею после пероральной нагрузки дисахаридами. Кроме того, после такой нагрузки в крови не удается обнаружить повышение гликемии в интервале 30-90 минут, как это отмечается у здоровых людей. Непереносимость лактозы обусловлена дефектом лактазы и проявляется также, как и вышеперечисленные состояния.
^ Нарушения метаболизма мукополисахаридов (гликозаминогликанов). Важнейшей составной частью соединительной ткани являются протеогликаны, состоящие из агрегированных мономерных субъединиц, содержащих центрально расположенное «белковое ядро», с которым связаны гликозидные цепи различных гликозаминогликанов (ГАГ). Количество и соотношение различных протеогликанов зависит от типа соединительной ткани. Они образуются в специальных клетках этой ткани – фибробластах, в лизосомах этих же клеток они после эндоцитоза разрушаются. Функции ГАГ – поддержание структурной целостности соединительной ткани и организация межклеточного матрикса. ГАГ взаимодействуют с компонентами клеточных мембран в таких процессах, как рост клеток, межклеточные коммуникации, восприятие информации, взаимодействие некоторых плазменных белков с сосудистой стенкой. Разрушение ГАГ начинается с терминального моносахарида под влиянием специфических гликозидаз. Если какие-либо из этих лизосомальных ферментов отсутствуют или их активность нарушена в соединительной ткани начинается накопление неразрушенных или частично разрушенных ГАГ. Это приводит к возникновению ряда заболеваний, объединенных общим названием мукополисахаридозы. Мукополисахаридозы отличаются прогрессирующим течением с различной степенью тяжести. Общие признаки различных форм этих заболеваний: деформация черт лица, изменение скелета, деформация суставов, поражение печени, селезенки, сердца, кровеносных сосудов. Характерна также задержка психомоторного и умственного развития. Ниже приводится характеристика некоторых форм мукополисахаридозов. Синдром Гурлера – обусловлен дефицитом α-L-идуронидазы. Протекает тяжело – больные умирают в возрасте до 10 лет. У детей отмечается деформация позвоночника, суставов, отставание в росте, комбинированная проводниковая и нейросенсорная глухота, гепатоспленомегалия. С мочой экскретируются гепаран- и дерматан-сульфаты.
^ Синдром Моркио – вызван дефектом галактозо-6-сульфатазы, которая расщепляет связь, имеющуюся только в кератансульфате. Это ведет к накоплению последнего в составе хрящей межпозвоночных дисков и роговицы, что и определяет клинику заболевания. Поражается преимущественно скелет – выступают нижние ребра, наступает х-образное искривление ног, характерно выпирание грудины и очень короткая шея. С мочой выделяется кератансульфат.
^ Дефицит глюкуронидазы – дефект, проявляющийся огрублением черт лица, гепатоспленомегалией, изменениями скелета. Лабораторно выявляется: наличие дерматан- и гепаран-сульфатов в моче, метахроматические гранулы в гранулоцитах периферической крови, снижение активности фермента в лейкоцитах и сыворотке крови.
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 1649; Нарушение авторских прав?; Мы поможем в написании вашей работы!