
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Биосинтез белка
|
|
|
|
1. Строение рибосомы
2. Свойства генетического кода
3. Этапы синтеза белка, необходимые факторы и их роль
В соответствии с основным постулатом молекулярной биологии синтез белков включает три процесса. Транскрипция — синтез информационной (матричной) РНК на ДНК-матрицена основе комплементарности. Это переписывание генетической информации с ДНК на РНК. В молекуле мРНК записана информация о последовательности аминокислот в первичной структуре белка с помощью триплетного нуклеотидного кода. У эукариот процесс идет в ядре.
Трансляция — перевод генетической информации мРНК, записанной с помощью четырех нуклеотидов, в первичную структуру белка (полипептид), записанную с помощью 20 аминокислот. Процесс идет в рибосомах. Для осуществления перевода нуклеотидного кода в аминокислотную последовательность существуют специальные молекулы-адаптеры. Роль адаптеров выполняют тРНК: с одного конца молекулы — аминокислота (З'-конец тРНК), а с другого — антикодон, т.е. триплет нуклеотидов, комплементарный кодону мРНК. В результате транскрипции и трансляции генетическая информация ДНК реализуется в виде первичной структуры белка.
Посттрансляционная модификация белков осуществляется в цитозоле, аппарате Гольджи и других местах клетки за счет специфического взаимодействия радикалов аминокислот первичной структуры и других молекул. При этом формируется нативная структура белка.
Рибосомы. Внутриклеточный компонент, в котором осуществляется процесс трансляции, называется рибосомой. Множество рибосом могут одновременно транслировать одну и ту же цепь мРНК, образуя так называемые полирибосомы (полисомы). Шероховатый эндоплазматический ретикулум — это компартмент клетки, в котором мембрансвязанные полисомы продуцируют как мембранные белки, так и белки, подлежащие экскреции и транспорту. Полирибосомные структуры присутствуют и в свободной форме — в цитозоле, где они синтезируют внутриклеточные белки. Рибосомы — это субклеточные частицы, состоящие из рРНК и белков. По константе седиментации различают 70S-рибосомы прокариот и 80S-рибосомы эукариот. Соотношение рРНК и белков у 70S-рибосом — 2:1, а у 80S-рибосом — 1:1. Рибосомные РНК синтезируются в ядрышке в виде предшественника 45S-рРНК, который затем расщепляется эндонуклеазами на рРНК нужной длины. Рибосомные белки образуются в цитоплазме и переносятся в ядрышко. Здесь спонтанно образуются рибосомные субъединицы путем объединения белков с соответствующими рРНК. Возникшие большая (50S — у прокариот и 60S — у эукариот) и малая (30S — у прокариот и 40S — у эукариот) субъединицы рибосом через поры ядерной оболочки переносятся в цитозоль. Большая субъединица рибосом эукариотической клетки содержит 41 белок, 5S-, 5,8S- и 28S-pPHK; малая — 30 белков и 18S-рРНК. В микробной клетке количество рибосом равно 10 000, а в эукариотической — достигает 100 000. Согласно представлениям Дж. Уотсона, существует «рибосомный цикл»: в начале синтеза полипептидной цепи субъединицы рибосомы объединяются в функционирующую рибосому на мРНК для осуществления трансляции, а в конце синтеза диссоциируют.
Генетический код. Информация о последовательности аминокислот в полипептидной цепи записана на мРНК в виде трехбуквенного нуклеотидного кода.
Основные свойства кода: триплетность — каждая аминокислота кодируется тройкой нуклеотидов, называемой кодоном; вырожденность — одну и ту же аминокислоту может кодировать несколько кодонов, причем важнейшую роль играют дня первых нуклеотида триплета; однозначность — каждому триплету соответствует только одна аминокислота; неперекрываемость — кодоны считываются один за другим не перекрываясь; универсальность — соответствие аминокислот триплетному коду у всех живых организмон (в последние годы показано, что в митохондриях различных клеток четыре кодона считываются иначе, чем постулировано принципом универсальности).
Среди 64 триплетов мРНК выделяют три типа:
1) инициирующие — АУГ и ГУГ (кодируют включение формилметионина у прокариот или метионина у эукариот), определяют стадию начала (инициации) синтеза белковой молекулы; 2) смысловые кодируют включение аминокислот в синтезируемую полипептиднуш цепь; 3) терминирующие — не кодируют включение аминокислот, это нонсенс-кодоны, которые определяют завершение (терминацию) синтеза полипептидной цепи.
Этапы синтеза белка и необходимые факторы. По А. Ленинджеру, выделяют пять этапов синтеза белковой молекулы: 1) активация аминокислот с образованием аминоацил-тРНК; 2) инициации полипептидной цепи; 3) элонгация полипептидной цепи; 4) терминация полипептидной цепи и освобождение; 5) сворачивание полипептидной цепи и процессинг (созревание).
Белоксинтезирующая система клетки должна иметь:
1) матрицу мРНК, на которой записана информация о последовательности аминокислотных остатков в синтезируемой полипептидной цепи,
2) рибосомы — субклеточные частицы, осуществляющие ферментативный синтез полипептидной цепи по матрице мРНК (точнее — полирибосома, являющаяся комплексом мРНК и рибосом);
3) набор всех типов аминоацил-тРНК. (набор молекул-адаптеров); различные регуляторные и вспомогательные факторы белковой природы;
4)АТФ, ГТФ, ионы магния и др.
Трансляция молекул мРНК начиняется с 5'-конца с образованием N- конца растущей полипептидной цепи. Информация считывается в направлении 5' —> 3' и заканчивается образованием С-конца белковой молекулы. Транскрипция гена в соответствующую мРНК начинается с образования 5'-конца молекулы мРНК. У прокариот это позволяет начать трансляцию мРНК еще до завершения транскрипции. У эукариот процесс транскрипции происходит в ядре, а трансляции мРНК — в цитоплазме. Такая компартментализация процессов исключает одновременное протекание транскрипции и трансляции и делает неизбежным процессинг предшественников мРНК — гяРНК.
Активация аминокислот. В цитоплазме клеток 20 различных аминокислот присоединяются эфирной связью к соответствующей т-РHK с образованием аминоацил-тРНК. Этот процесс катализируется высокоспецифичными аминоацил-тРНК-синтетазами:
аминокислота + тРНК + АТФ -> аминоацил-тРНК + АМФ + РРн.
Многие аминоацил-тРНК-синтетазы способны исправлять ошибки при присоединении близких по структуре аминокислот. Например, при включении валина вместо изолейцина (различие на одну метиленовую группу) фермент способен распознать ошибку, когда аминокислота поступает в активный центр, и гидролитически отщепить неправильную аминокислоту. Именно поэтому в этих ферментах выделяют четыре важных для катализа места связывания: для аминокислоты, тРНК, АТФ и для воды (гидролиз «неправильных» аминоацил-тРНК).
Инициация полипептидной цепи. Для инициации полипетидной цепи в клетках прокариот необходимы: мРНК, инициирующая аминоацил-тРНК, малая и большая субъединицы рибосом. Они собираются в работающий ансамбль с помощью трех белков (факторы инициации) IF-1, IF-2, IF-3, ионов магния и ГТФ. Инициирующая аминоацил-тРНК у прокариот представлена формилметионин-тРНК, а у эукариот — метионин-тРНК. Стадия инициации начинается с присоединения IF-3 к малой субъединице рибосомы. Этот фактор обеспечивает узнавание на мРНК участка для присоединения инициирующей тРНК, т.е. инициирующего кодона (АУГ, ГУГ). В это же время инициирующая формилметионин-тРНК связывается с IF-2 и ГТФ. Затем оба комплекса взаимодействуют и образуется инициирующий комплекс, который связывается с мРНК. Это связывание происходит с помощью фактора IF-1, который способствует соединению мРНК с инициирующим комплексом, состоящим из малой субъединицы, формилметионин-тРНК, IF-2, IF-3, ГТФ. Белковый фактор IF-2 способствует соединению большой и малой субъединиц рибосомы. После присоединения большой субъединицы высвобождаются все инициирующие факторы, ГДФ и неорганический фосфат, т.е. процесс идет с затратой энергии. Смысл всех этих операций заключается в том, что мРНК соединяется с инициирующей (формил)метионин-тРНК в рибосоме единственно возможным способом, определяющим точное положение рамки считывания кодонов мРНК на инициирующем кодоне.
В работающей рибосоме есть два участка связывания транспортных РНК (тРНК): А-участок (аминоацильный), имеющий сродство к аминоацил-тРНК, и Р-участок (пептидильный), имеющий сродство к пептидил-тРНК. В конце стадии инициации инициирующая (формил)метионин-тРНК находится в Р-участке собранной рибосомы и соединена водородными связями с инициирующим кодоном мРНК. В А-участке находится следующий кодон мРНК.
Элонгация полипептидчой цепи. Для осуществления элонгации необходимы: набор аминоацил-тРНК, ГТФ, ионы магния, факторы элонгации — EF-T и EF-g. Она начинается с присоединения аминоацил-тРНК к следующему за инициирующим кодону мРНК в А-участке рибосомы. Каждое присоединение аминоацил-тРНК требует затраты молекулы ГТФ и происходит при участии EF-T. Между кодоном мРНК и антикодоном аминоацил-тРНК замыкаются водородные связи. Когда два аминокислотных остатка оказываются рядом, между ними образуется водородная связь. Процесс катализируется рибосомным ферментом пептидилтрансферазой и использует энергию макроэргической связи аминоацил-тРНК. Образовавшийся дипептид силами гидрофобного взаимодействия радикалом связан с Р-участком. В то же время он связан с тРНК, находящейся в А-участке и связанной с кодоном мРНК. Сродства к А-участку эта пептидил-тРНК не имеет. При участии EF-g и за счет энергии ГТФ происходит перемещение пептидил-тРНК в Р-участок, а вместе с ней и кодона мРНК, так как они связаны водородными связями. Фактор EF-g считают ГТФазой. Такое перемещение называют транслокацией. (Формил)метионин-тРНК при этом высвобождается из рибосомы. В результате транслокации в А-участок рибосомы приходит новый кодон мРНК. К нему методом случайного подбора присоединяется комплементарным антикодоном новая аминоацил-тРНК. Между дипептидом Р-участка и аминокислотным остатком в А-участке замыкается пептидная связь. Возникший трипептид транслоцируется в Р-участок, а в А-участок приходит следующий новый кодон мРНК и т.д. Таким образом, происходит многократное повторение этапов элонгации, пока в А-участок не придет один из терминирующих кодонов.
Терминация полипептидной цепи. Необходимые факторы: FR-1 воспринимает триплеты УАА и УАГ; FR-2 воспринимает УАА и УГА; ГТФ. Терминирующие кодоны (бессмысленные, нонсенс-кодоны) не имеют для себя аминоацил-тРНК. Кодоны, поступив в А-участок, воспринимаются факторами FR-1 или FR-2, которые индуцируют пептидилэстеразную активность, вследствие чего отщепляется синтезировавшийся полипептид. Весь комплекс трансляции диссоциирует на составные части.
В цитоплазме клеток прокариот с помощью фермента деформилазы происходит отщепление формильной группы от N-концевого формилметионина синтезированного полипептида; часто после завершения синтеза в цитоплазме клеток отщепляется N-концевой метионин от синтезированного полипептида (у прокариот и эукариот). На основе взаимодействия радикалов аминокислотных остатков полипептидной цепи спонтанно формируются вторичная, третичная, а у олигомерных белков и четвертичная структуры.
Посттрансляционная модификация белка включает следующие процессы: химическую модификацию белка (часто отсутствует) — метилирование по аминогруппе лизина и аргинина, фосфорилирование по ОН-группе серина, окисление лизина, пролина и др.; связывание простетической группы; связывание между собой субъединиц олигомерного белка; частичный протеолиз.
Например, посттрансляционная модификация при биосинтезе гликопротеинов происходит следующим образом. Полисомы связаны с внешней поверхностью мембраны эндоплазматического ретикулума клеток через большую субъединицу рибосомы. Синтезированные полипептидные цепи проходят через мембрану шероховатого эндоплазмати-ческого ретикулума в цистерны и переносятся в гладкий эндоплазматический ретикулум и в комплекс Гольджи. Здесь с помощью гликозилтрансфераз происходит присоединение моносахаридных молекул к полипептидным цепям с образованием гликопротеинов.
Регуляция биосинтеза белков. В настоящее время считают, что регуляции подвержены все или почти все этапы биосинтеза белков. Например, метаболиты и гормоны могут изменять сродство белков-репрессоров к регуляторным отделам ДНК; гормоны способны модифицировать активность метилаз, участвующих в биосинтезе рРНК; новообразованные белки способны активировать рибонуклеазы и тем самым ускорять распад своих мРНК и т.п.
Согласно теории Жакоба и Моно, в биосинтезе белков у бактерий участвуют три типа генов: структурные гены, ген-оператор и ген-регулятор. Структурные гены определяют первичную структуру белков. Функционирование структурных генов контролируется геном-оператором (локализован между промотором и структурными генами). Формирование мРНК начинается с промотора и далее распространяется вдоль оператора и контролируемых им структурных генов. Оператор и структурные гены называют опероном. Деятельность оперона контролируется геном-регулятором. Оперон и ген-регулятор находятся в разных участках цепи ДНК, поэтому связь между ними осуществляется с помощью белка-репрессора, синтезируемого по информации гена-регулятора. Если репрессор связан с геном-оператором, то РНК-полимераза не может синтезировать мРНК, а следовательно, не синтезируются и белки. Если ген-оператор свободен, процесс транскрипции возможен и информация структурных генов используется для синтеза белков.
Рассмотрим превращения:
Е' Е2 Е3
A->B->C->D
Чтобы исходное вещество А превратилось в конечный продукт D, необходимы ферменты Е1,2,3. Если это неразветвленный процесс, то синтез этих ферментов кодируется одним опероном.
Установлено, что при отсутствии вещества А репрессор связан с геном-оператором и синтез белков-ферментов Е1,2,3 не идет. При появлении метаболитов возможны два варианта:
1) индукция синтеза ферментов. Исходное вещество А, подлежащее превращениям, понижает сродство репрессора к гену-оператору. В результате РНК-полимераза осуществляет синтез мРНК. Затем синтезируются белки-ферменты Е1,2,3. Они обеспечивают превращения вещества А в D;
2) репрессия синтеза ферментов. Конечные продукты реакции (их называют корепрессоры) повышают сродство репрессора к гену-оператору. Это приводит к блокировке гена-оператора, и матричный синтез мРНК прекращается, что сопровождается подавлением синтеза белков Е1,2,3.
Регуляция синтеза белков в клетках эукариот намного сложнее, так как:
· не характерна прямая субстратная регуляция, так как опероны (транскриптоны) имеют обширные регуляторные зоны;
· структурные гены разбросаны по геному;
· в ядрах дифференцированных клеток эукариот большинство генов находится в репрессированном состоянии;
· все структурные гены делят у эукариот на три группы — гены, функционирующие во всех клетках организма, в тканях одного типа, и специализированных клетках одного типа;
· пространственное разделение процессов — транскрипция в ядре, трансляция в рибосомах.
В молекуле ДНК-матрицы имеется особый участок — промотор, — с которого РНК-полимераза начинает синтез РНК, а также участок, сигнализирующий о завершении процесса. На стадии транскрипции действуют некоторые тонкие механизмы регуляции белкового синтеза. Существует два вида воздействия на белковый синтез: репрессия (подавление) и индукция (yсиление) его. Как уже отмечалось, в молекулах ДНК содержат регуляторные гены. Они кодируют аминокислотную последовательность специфических белков — репрессоров, многие из которых являются гистонами. Репрессор в обычном порядке синтезируется в рибосомах и затем связывается с молекулой ДНК на так называемом акцепторном участке, расположенном непосредственно рядом со структурными генами. Такое связывание мешает РНК-полимеразе синтезировать и-РНК на поверхности структурного гена. В молекуле репрессора есть особый центр связывания с ДНК, пространственная структура которого может меняться в зависимости от внешних воздействий. Если в клетке появляется вещество-индуктор, то, присоединяясь в репрессору, оно так изменяет структру этого центра, что связывание становится невозможным и РНК-полимераза начинает синтезировать и-РНК на структурных генах (рис. 74). Имеются сведения об индукции белкового синтеза гормонами. Таким действием обладают некоторые стероидные гормоны надпочечников, тироксин и ряд других. Во многих случаях белки-репрессоры теряют способность подавлять синтез и-РНК, образуя соединения с фосфорной кислой. Мощными активаторами фосфорилирования репрессорных белков являются ц-АМФ и ц-ГМФ.
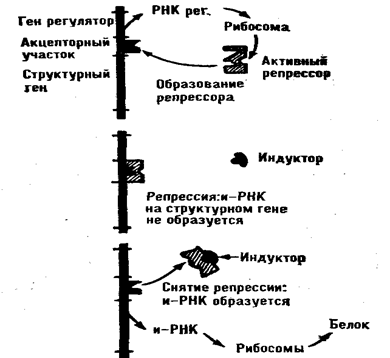 -
-
Схема действия индуктора
В некоторых случаях репрессор сам по себе мало активен. Для подавления белкового синтеза ему нужен корепрессор. Это метаболит, присоединение которого к репрессору изменяет структуру центра связывания так, что репрессор становится способным реагировать с акцепторным участком ДНК и тормозить синтез и-РНК на структурных генах (рис. 75).
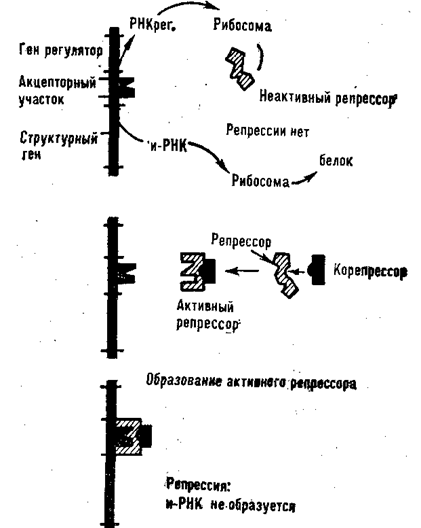
Схема действия корепрессора
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2724; Нарушение авторских прав?; Мы поможем в написании вашей работы!