
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия в биологических системах
|
|
|
|
1.1. Примеры бифуркации в системах
Огромное количество молекул, атомов в природе обычно находится в объединениях-коллективах, которые принято называть системами. Так атмосфера Земли объединена в систему благодаря наличию в ней взаимодействующих гравитационных, температурных, электромагнитных полей.
Человек представляет собой систему атомов и молекул, в которой взаимодействуют все виды энергетических полей, известных сегодня науке: гравитационное, температурное, химическое, ядерное, электромагнитное и т.д.
Закономерности существования систем с разной степенью приближения к истинно природным явлениям устанавливаются учеными в виде разнообразных моделей и математических формул.
Представляют интерес две модели систем: закрытые (замкнутые, консервативные) и открытые. Закрытая система взаимодействует только сама с собой внутри себя, допуская интегративно-нулевое взаимодействие с другими системами. Открытая система взаимодействует с другими системами. Деление достаточно условно. Так, например, атмосферу Земли можно рассматривать в первом приближении как закрытую систему, так как силы её взаимодействия с энергетическими полями Земли значительно больше, чем силы взаимодействия с другими планетами, с отдельным человеком и т.д.
Одним из основных законов для модели закрытая система является второй закон термодинамики. Он констатирует, что замкнутая система имеет своим естественным равновесным состоянием - хаос, т.е. такое динамическое состояние равновесия, в котором энергия распределена в среднем поровну между частицами системы. Так, если брать за образец атмосферу Земли, то мы увидим, что химический состав её в естественном состоянии равномерен. В случае повышения концентрации какого-то химического элемента или температуры в данном локальном месте сразу же начинаются процессы, которые ведут к выравниванию.
Чисто замкнутых систем в природе нет, ибо любая система связана на различных энергетических уровнях с другими системами. Так атмосфера Земли: взаимодействует с различными видами космических излучений, которые пронизывают её, оставляют в ней энергию; не может выровнять концентрацию химических элементов и температуру по радиусу (по высоте) от Земли и т.д. Тот факт, что любая замкнутая система является условно замкнутой, позволяет снять многие парадоксы, возникшие в результате слепого постулирования второго начала термодинамики.
Все ли мы знаем о поведении огромного количества атомов и молекул? Казалось, с появлением законов термодинамики появилась такая наезженная колея в сознании, что ничего новенького, любое отклонение можем предсказать и рассчитать. Правда, есть облачко на горизонте, как это уже было в истории науки неоднократно и наиболее ярко - в конце XIX столетия. Наука считает, что огромное количество атомов и молекул располагается в пространстве хаотично в состоянии динамического равновесия. Только вот как снять парадокс: Естественным состоянием природы в замкнутой системе является – хаос. В таком случае откуда же берутся в ней симметричные объекты: кристаллы, люди ” - это большой вопрос. Анализ [1] показывает,что с огромными
случаются казусы почище парадокса. Идет все по закону и хаос торжествует, а тут ба – бах - и катаклизма!
Пример? Пожалуйста, поближе к дому. Воздух в комнате. Идеальный пример торжества законов термодинамики. При температуре +200С атомы и молекулы мечутся. Скорости достигают значений, показанных в предыдущем параграфе. Но давайте будем понижать температуру. Что-то с воздухом стало происходить. Он перестал быть прозрачным и вдруг – (это же ужас!) прямо из воздуха начали появляться объекты, которые мы сами видим своими глазами. Да поглядите внимательнее - они же симметричны. Это не хаос какой-то, это же элегантные снежинки с великолепной симметрией. Что произошло? Хаос родил симметрию! Да какую! Сам И. Кеплер не обошел вниманием такую красоту [2]. Оказывается, на температурной оси есть такое значение температуры, при котором хаос рождает два состояния: хаос и порядок. Начался процесс бифуркации, [ < bifurcus раздвоенный] [3].
Значение температуры в данном примере, вообще значение любого параметра, при достижении которого начинается процесс бифуркации, называют точка бифуркации.
Другой пример,- и тоже с воздухом. Давайте температуру будем увеличивать. Выйдем в теплое море - эдак куда- нибудь южнее Японии. Огромные зеркала воды, острова и солнце нещадно палит. Разогрев атмосферы происходит неравномерно. Какие-то участки поверхности, особенно неоднородные: мели, рифы, острова, поверхность воды – и отражают неодинаковое количество тепла. Молекулы воздуха, запасая энергию, начинают раскручиваться. Раскрутка захватывает целые воздушные зоны, наконец, масса воздуха срывается в закрутку. Возникает вихрь, который вобрал в себя избытки энергии Солнца. Вращение его происходит в огромном пространстве относительно холодного воздуха, окружающего вихрь. Возникло явление бифуркации в атмосфере.
А вот неожиданный ракурс локализации энергии. Просто кипарис и кипарис Ван Гога. Посмотрите, какие вихри нарисовал Ван Гог, и сколько тревоги и энергетической емкости добавилось на полотне!
Рассмотрим хорошо знакомую нам в обиходе воду. Её молекула - H2O. Интересно ведет она себя при изменениях температуры:
·






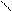




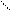



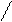
















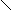



 . · · · ··
. · · · ··

 · · · · ·
· · · · ·


 · · · ·· hn
· · · ·· hn
 · ·· · ···
· ·· · ···
· ·
2 1 0 3 4
 |
273 293 373 2000 5000 T,К
Рис. 2. Геометрическая форма упаковки H2O
как функция температуры T
На температурной шкале возникает несколько замечательных точек (температурных зон), в которых происходит разделение среды - бифуркация. При повышении температуры за точкой 0 встречаем зону динамического равновесия 3, где молекулы начинают раскручиваться. Достаточно незначительных неоднородностей, как начинают возникать локальные вихри. В кручении вихрей принимает участие много молекул. В точке 4 приток энергии столь велик, что внутри каждой молекулы возникают сложные отношения между атомами. Химические связи с трудом удерживают атомы в химическом соединении. Атомы начинают ходить-колебаться друг относительно друга, будто они на пружинках. В этой температурной зоне возникает совершенно удивительное преобразование хаоса в порядок периодики: из молекул начинает рождаться электромагнитное излучение строго определенных частот. При понижении температуры за точкой 0 изпара в зоне 1 образуется вода в известном нам жидком виде. Возникает бифуркационное явление (из хаоса рождается порядок) - вода - жидкий кристалл с так называемым ближним порядком. При переходе через температурную точку 2 из достаточно подвижной, пластичной, текучей воды начинает выстраиваться кристаллическая структура с дальним порядком. Все атомы выстраиваются как солдаты на плацу во время парада. (Позвольте еще раз напомнить, что человек в основном состоит из воды.)
1.2. Кросс – катализ
Получается, что для природы характерно наличие точек бифуркации по определенным параметрам (мы рассмотрели только один параметр - температуру). Для природы характерно запасать энергию в определенном диапазоне температур в виде вращательного движения.
Для человеческого организма не чужд класс каталитических реакций - так называемый кросс-катализ (перекрестный катализ). Он играет существенную роль в метаболических* функциях (метаболизм от греч. metabole-перемена, превращение) [4]. Приведем пример такой реакции, описанной в [1]:
 * Слово использовано в узком смысле – промежуточный обмен, т.е. превращение определенных веществ внутри клеток с момента их поступления до образования конечных продуктов.
* Слово использовано в узком смысле – промежуточный обмен, т.е. превращение определенных веществ внутри клеток с момента их поступления до образования конечных продуктов.

 A X B
A X B
 |
 D
D
 |
|
|
|
|
|
Дата добавления: 2015-04-25; Просмотров: 734; Нарушение авторских прав?; Мы поможем в написании вашей работы!