
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Практическая часть. Кислотно-основное состояние (КОС) крови и ротовой жидкости (понятие о щелочном резерве, ацидозе и алкалозе)
|
|
|
|
Учебная карта темы.
Кислотно-основное состояние (КОС) крови и ротовой жидкости (понятие о щелочном резерве, ацидозе и алкалозе).
Буферные системы (определение).
1.1. Классификация (кислотные, основные, амфотерные) и основные компоненты буферных растворов.
1.2.Уравнения Гендерсона-Гассельбаха (вывод формул). Влияние разведения и концентрирование на величину рН буферов.
1.3. Механизм действия ацетатного и аммонийного буферных систем.
1.4. Буферная ёмкость и факторы, определяющие данную характеристику, методы определения.
2.Буферные системы крови и ротовой жидкости, механизм их действия.
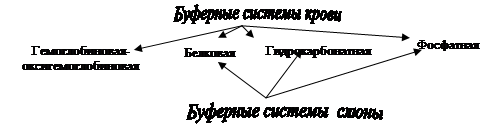
6. Буферная ёмкость системы организма.
1. Практическая часть:
1.1. Примеры решение ситуационных задач.
1.2. Вопросы и ситуационные задачи для закрепления материала.
1.3. Контрольные вопросы.
2. Экспериментальная часть (лабораторная работа).
3. Контроль усвоения темы (тесты текущего уровня).
1.1.Ситуационные задачи (№№ с 1- по 4) с алгоритмами их решений, эталонами ответов и с комментариями.
Вычисление рН буферного раствора
Задача №1. Три раствора содержат уксусную кислоту / 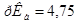 / концентрации 0,10 моль/л и ацетата натрия концентрации 0,10 (а), 0,20 (б) и 0,50 (в) моль/л. Вычислите рН этих растворов.
/ концентрации 0,10 моль/л и ацетата натрия концентрации 0,10 (а), 0,20 (б) и 0,50 (в) моль/л. Вычислите рН этих растворов.
Решение.
1. Расчет рН буферных растворов производится по уравнению Гендерсона-Гассельбаха: 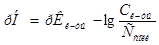 /или
/или  .
.
Подставляем числовые данные и получаем:
а) 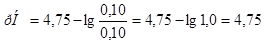 ;
;
б) 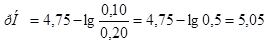 ;
;
в) 
Ответ. а)  ; б)
; б) 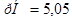 ; в)
; в) 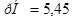 .
.
Вычисление изменения рН буферных растворов, вызванных добавлением кислоты или щелочи
Задача №2. Для экспериментального определения содержания ионов 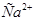 в образце консервированной крови методом комплексонометрии, необходимо приготовить аммиачный буфер с рН 8-10. Однако данное значение не должно быть выше 10,т.к. в этом случае выпадает осадок гидроксида металла. Вычислите рН аммиачной буферной системы, содержащей по 0,5 М гидроксида аммония
в образце консервированной крови методом комплексонометрии, необходимо приготовить аммиачный буфер с рН 8-10. Однако данное значение не должно быть выше 10,т.к. в этом случае выпадает осадок гидроксида металла. Вычислите рН аммиачной буферной системы, содержащей по 0,5 М гидроксида аммония 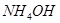 и хлорида аммония
и хлорида аммония 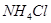 . Как изменится рН при добавлении к 1 л этой смеси 0,1 М
. Как изменится рН при добавлении к 1 л этой смеси 0,1 М 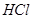 и при добавлении к 1 л этой смеси 0,1 М
и при добавлении к 1 л этой смеси 0,1 М 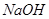 и при разбавлении раствора водой в 10 раз, если
и при разбавлении раствора водой в 10 раз, если 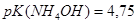 ?Правильно ли приготовлен буферный раствор?
?Правильно ли приготовлен буферный раствор?
Решение.
1. рН исходной смеси растворов 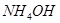 и
и 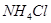 вычислить по формуле:
вычислить по формуле: 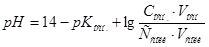 . Следовательно,
. Следовательно, 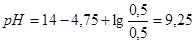 .
.
2. При добавлении к буферному раствору 0,1 М 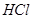
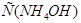 уменьшится на 0,1 М и станет равной 0,4 М, а С(
уменьшится на 0,1 М и станет равной 0,4 М, а С(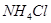 ) возрастет до 0,6 М. Следовательно,
) возрастет до 0,6 М. Следовательно,  .
.
3. При добавлении же 0,1 М 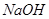 к 1 л смеси
к 1 л смеси 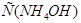 увеличится до 0,6 М, а
увеличится до 0,6 М, а  уменьшится до 0,4 М, в результате этого получим:
уменьшится до 0,4 М, в результате этого получим:  .
.
4. При разбавлении буферного раствора водой в 10 раз будем иметь: 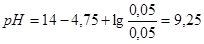 .
.
Ответ. 1)  (исходной смеси); 2)
(исходной смеси); 2)  (при добавлении
(при добавлении 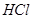 ); 3)
); 3) 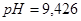 (при добавлении
(при добавлении 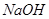 ); 4)
); 4)  (при разбавлении водой). Буферный раствор приготовлен удовлетворительно, т.к. оптимальная величина рН для определения
(при разбавлении водой). Буферный раствор приготовлен удовлетворительно, т.к. оптимальная величина рН для определения  (или
(или  ) около 9.
) около 9.
Вычисление соотношения объемов компонентов буферной системы с определенным рН
Задача №3. Вычислите объем раствора натрий формиата с 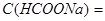 0,1 моль/л и объем муравьиной кислоты
0,1 моль/л и объем муравьиной кислоты  =0,1 моль/л, которые необходимы для приготовления 2 л формиатного буфера с рН=3,15 (
=0,1 моль/л, которые необходимы для приготовления 2 л формиатного буфера с рН=3,15 ( ).
).
Решение.
8. Из формулы расчета рН:  следует:
следует: 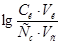
 .
.
9. С учетом того, что 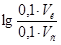
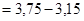 =0,60, получаем:
=0,60, получаем: 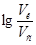 =0,60.
=0,60.
10. 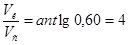 . Следовательно, необходимо 4 части раствора кислоты и одну часть раствора соли для приготовления буферной системы с рН=3,15.
. Следовательно, необходимо 4 части раствора кислоты и одну часть раствора соли для приготовления буферной системы с рН=3,15.
11. Находим нужный объем кислоты и соли:  мл,
мл, 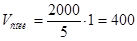 мл.
мл.
Ответ. 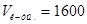 мл;
мл; 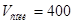 мл.
мл.
Вычисление буферной ёмкости
Задача №4. К 100 мл к ротовой жидкости для изменения рН от 7,8 до 7,4 надо добавить 3,6 мл HCl 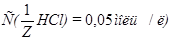 , какова буферная ёмкость
, какова буферная ёмкость 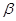 этой жидкости?
этой жидкости?
Решение.
8. Буферную ёмкость 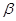 вычисляем по формуле:
вычисляем по формуле:
 =
=  =
= 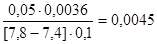 моль/л.
моль/л.
Ответ. 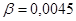 моль/л.
моль/л.
1.2. Ситуационные задачи (№№ с 5 по 14) для закрепления материала (выполнить в протокольной тетради).
Задача №5. Раствор формальдегида способен придавать тканям упругость и поэтому его применяют для консервации анатомических и биологических препаратов. Но при длительном хранении этого раствора происходит окислительно-восстановительная реакция, в результате чего образуются молекулы метилового спирта и муравьиной кислоты. Для нейтрализации кислоты используется фосфатный буферный раствор. Рассчитайте значение рН буферной смеси, содержащей в 1 л раствора 0,10 моль 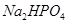 и 0,30 моль
и 0,30 моль 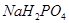 . Константа диссоциации ортофосфорной кислоты Н3РО4 по второй ступени равна
. Константа диссоциации ортофосфорной кислоты Н3РО4 по второй ступени равна 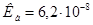 ;
; 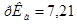 .
.
Задача №6. Каков рН буферного раствора, приготовленного смешением 20 мл 0,2М раствора 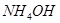 и 50 мл 0,5 М раствора
и 50 мл 0,5 М раствора 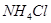 ?
?  . рКа (СН3СООН)=4,74.
. рКа (СН3СООН)=4,74.
Задача №7. Вычислить рН раствора, полученного путем смешивания 20 мл 0,05 М раствора азотистой кислоты 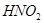 и 30 мл 1,5 М раствора нитрита натрия
и 30 мл 1,5 М раствора нитрита натрия 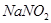 .
.
Задача №8. Определите рН буферного раствора, содержащего в 1 л 0,4 моль муравьиной кислоты и 1,0 моль формиата натрия, до разбавления и после разбавления в 50 раз, если  = 3,75.
= 3,75.
Задача №9. Гидрокарбонатная буферная система обеспечивает 80% буферных свойств слюны, а повышенные потери  , ограничение выведения
, ограничение выведения  и
и 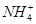 ведут к развитию метаболического ацидоза. Каково соотношение бикарбоната натрия и угольной кислоты в ротовой жидкости, рН которой=7,4, если суммарный
ведут к развитию метаболического ацидоза. Каково соотношение бикарбоната натрия и угольной кислоты в ротовой жидкости, рН которой=7,4, если суммарный 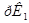 в слюне 6,11?
в слюне 6,11?
Задача № 10. рН ротовой жидкости в норме 5,8-7,5, а при нарушениях кислотно-щелочного равновесия может изменяться в пределах 4,5-8,3. При каких соотношениях количеств 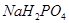 и
и 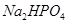 рН ротовой жидкости становится равным: а) 4,5; б) 8,3.
рН ротовой жидкости становится равным: а) 4,5; б) 8,3.
Задача №11. Буферный раствор приготовлен из 50 мл 0,3 М раствора 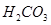 /
/ 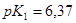 / и 40 мл 0,5 М раствора
/ и 40 мл 0,5 М раствора 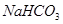 . а) Определите рН этого буферного раствора. б) Как изменится рН, если к этому раствору прибавить 10 мл 0,2 М
. а) Определите рН этого буферного раствора. б) Как изменится рН, если к этому раствору прибавить 10 мл 0,2 М 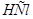 ? в) Рассчитайте буферную емкость по кислоте.
? в) Рассчитайте буферную емкость по кислоте.
Задача № 12. К 100 мл ротовой жидкости для изменения рН на единицу надо добавить 1,8 мл 0,2 М раствора HCl. Какова буферная ёмкость ротовой жидкости по кислоте?
Задача №13. Сколько щелочи нужно добавить к 1 мл десневой жидкости, чтобы изменить их рН от 7,9 до 8,3, если буферная ёмкость белкового буфера 0,034 моль/л?
Задача №14. Буферная ёмкость раствора по основанию равна 45 ммоль/л. Вычислите, какой объем раствора гидроксида натрия с молярной концентрацией 0,1 моль/л можно добавить к 250 мл этого раствора, чтобы сместить рН не более чем на 0,3 единицы?
Контрольные вопросы и задачи
9. Что выполняет роль слабой кислоты в фосфатном буфере: гидрофосфат или дигидрофосфат?
10. Почему при выводе формул рН буферных растворов равновесную концентрацию слабых электролитов можно принять за исходную?
11. Докажите, что небольшое разбавление практически не влияет на рН буферных систем.
12. Почему максимальная буферная ёмкость наблюдается при соотношении компонентов 1:1?
13. Почему буферная ёмкость по кислоте и по щелочи не всегда совпадает?
14. Какая буферная система вносит максимальный вклад в буферную ёмкость ротовой жидкости и крови?
15. Как используется уравнение Гендерсона–Гассельбаха при оказании помощи пациентам с отравлениями?
16. При введении в раствор формиата аммония: ионов а)  и б)
и б)  протекают следующие процессы: а)
протекают следующие процессы: а) 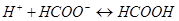 ; б)
; б) 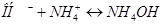 . Будет ли раствор
. Будет ли раствор 
 проявлять буферные свойства?
проявлять буферные свойства?
17. Какое соотношение 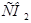 и
и  опасно для жизни и зачем в организме создается резерв
опасно для жизни и зачем в организме создается резерв 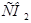 ?
?
18. При подъеме в горы наблюдается гипервентиляция легких. Какое нарушение кислотно-основного гомеостаза при этом возможно?
19. Что такое алкалоз и ацидоз и как изменяется рН при выдохе?
20. Какова должна быть концентрация ацетата натрия в 0,01 М растворе уксусной кислоты, чтобы концентрация ионов  в растворе была равна
в растворе была равна 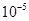 моль/л?
моль/л?
21. Какую из кислот: 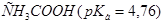 ,
,  ,
, 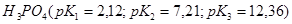 лучше выбрать для приготовления буферного раствора с наибольшей буферной ёмкостью и с рН= 7,45? Как приготовить 100 мл такого раствора из 1 М растворов компонентов?
лучше выбрать для приготовления буферного раствора с наибольшей буферной ёмкостью и с рН= 7,45? Как приготовить 100 мл такого раствора из 1 М растворов компонентов?
22. Для приготовления трех буферных растворов использовали 1,0 М растворы гидрофосфата и дигидрофосфата натрия, смешав их в соотношениях: а) 8:2; б)5:5; в) 3:7. У какого раствора будет максимальная буферная ёмкость и наибольшее значение рН?
23. Рассчитайте величину буферной ёмкости фосфатного буферного раствора, если после добавления 10 мл 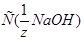 =0,5 моль/л к 20 мл этого раствора рН последнего увеличивается с 7,2 до 8,0.
=0,5 моль/л к 20 мл этого раствора рН последнего увеличивается с 7,2 до 8,0.
24. Во сколько раз концентрация водородных ионов в крови (рН=7,36) больше, чем в спинномозговой жидкости (7,53)?
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 2579; Нарушение авторских прав?; Мы поможем в написании вашей работы!