
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретическая часть. Изучение атомных спектров послужило ключом к познанию строения атомов
|
|
|
|
Изучение атомных спектров послужило ключом к познанию строения атомов. Прежде всего, было замечено, что линии в спектрах атомов расположены на беспорядочно, а объединяются в группы или, как их называют, серии линий. Отчетливее всего это обнаруживается в спектре простейшего атома водорода. На рисунке 1 представлена часть спектра атомарного водорода в видимой и близкой ультрафиолетовой области. Символами 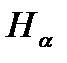 ,
, 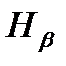 ,
, 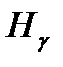 ,
,  обозначены видимые линии.
обозначены видимые линии. 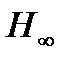 указывает границу серии. Очевидно, что линии располагаются в определенном порядке.
указывает границу серии. Очевидно, что линии располагаются в определенном порядке.
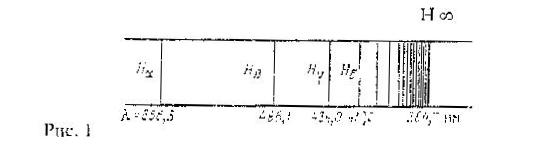
Расстояние между линиями закономерно убывает по мере перехода от более длинных волн к более коротким. Швейцарский физик Бальмер (1885) обнаружил, что длины волн этой серии, линий водорода могут быть точно представлены формулой:
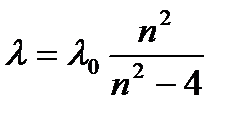 , (1)
, (1)
где 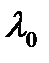 - константа;
- константа;
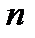 - целое число, принимающее значение 3, 4, 5 и т.д.
- целое число, принимающее значение 3, 4, 5 и т.д.
Если перейти в (1) от длины волны к частоте, получится формула:
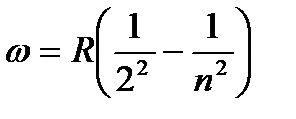 , (2)
, (2)
где 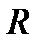 - константа, называемая в честь шведского спектроскописта постоянной Ридберга. Она равна:
- константа, называемая в честь шведского спектроскописта постоянной Ридберга. Она равна:
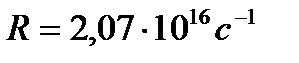 (3)
(3)
Формула (2) называется формулой Бальмера, а соответствующая серия спектральных линий водородного атома серией Бальмера. Дальнейшие исследования показали, что в спектре водорода имеются еще несколько серий. В ультрафиолетовой части спектра находится серия Лаймана, остальные серии лежат в инфракрасной области. Линии этих серий могут быть представлены в виде формул, аналогичных (2):
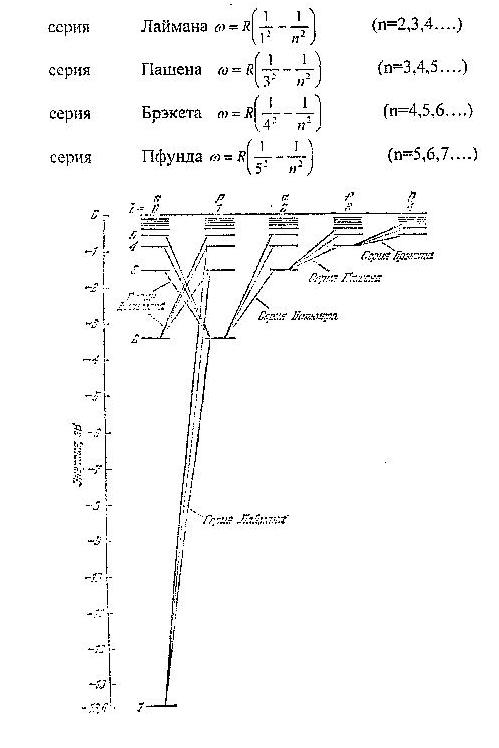
Частоты всех линий спектра водородного атома можно представить одной формулой:
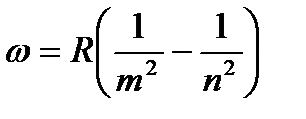 , (4)
, (4)
где 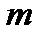 имеет значение 1 для серии Лаймана, 2 – для серии Бальмера и т.д. При заданном
имеет значение 1 для серии Лаймана, 2 – для серии Бальмера и т.д. При заданном 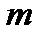 число
число 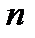 принимает все целочисленные значения, начиная с
принимает все целочисленные значения, начиная с  . При возрастании
. При возрастании 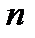 частота линии в каждой серии стремится к предельному значению
частота линии в каждой серии стремится к предельному значению 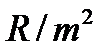 , которое называется границей серии (на рисунке 1 символом
, которое называется границей серии (на рисунке 1 символом 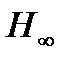 отмечена граница серии Бальмера).
отмечена граница серии Бальмера).
Возьмем ряд значений выражения 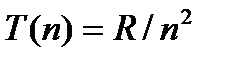 :
:
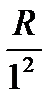 ,
,  ,
, 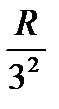 … (5)
… (5)
Частота любой линии спектра водорода может быть представлена в виде разности двух чисел ряда (5). Эти числа называют спектральными термами или просто термами. Так, например, частота первой линии серии Бальмера равна T(2) второй линии серии Пфунда T(0) T(7) и т.д. Изучение спектров других атомов показало, что частоты линий и в этом случае могут быть представлены в виде разностей двух термов (комбинационный принцип Ритца):
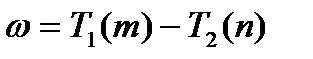 (6)
(6)
Однако терм 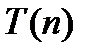 обычно имеет более сложный вид, чем для водородного атома. Кроме того, первый и второй члены формулы (6) берутся из различных рядов термом. Теоретическое обоснование эмпирической формулы Бальмера дает квантомеханический подход. В рамках данного подхода для атома водорода записывается уравнение Шредингера:
обычно имеет более сложный вид, чем для водородного атома. Кроме того, первый и второй члены формулы (6) берутся из различных рядов термом. Теоретическое обоснование эмпирической формулы Бальмера дает квантомеханический подход. В рамках данного подхода для атома водорода записывается уравнение Шредингера:
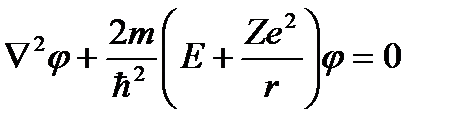 (7)
(7)
Далее ищутся решения данного уравнения на собственные значения. Уравнение (7) имеет однозначные, непреревные, конечные решения при дискретных отрицательных значениях энергии 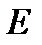 :
:
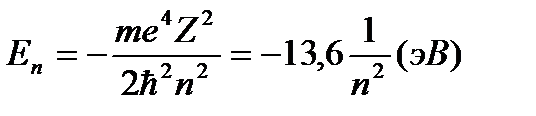
 1, 2, 3, 4…) (8)
1, 2, 3, 4…) (8)
Число 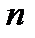 , фигурирующее в формуле (8), называется главным квантовым числом.
, фигурирующее в формуле (8), называется главным квантовым числом.
Сравнивая (8) с бальмеровским видом записи спектральных термов, приходим к выводу, что совокупность спектральных термов отображает закон квантования энергетического спектра атома водорода, а постоянная Ридберга для атома водорода может быть представлена в виде:
 (9)
(9)
|
|
|
|
|
Дата добавления: 2015-05-06; Просмотров: 393; Нарушение авторских прав?; Мы поможем в написании вашей работы!