
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Участие аминокислот в процессах биосинтеза
|
|
|
|
Тканевой обмен аминокислот
Фонд аминокислот, образовавшийся в результате ферментативного расщепления пищевых продуктов или продуктов распада тканей, расходуется на биосинтез белков и многих других соединений, свойственных только данному организму, на энергетические затраты, а также на образование конечных продуктов азотистого обмена, подлежащих выведению (рис. 1).
Синтез специфических для данного организма белков находится под контролем молекул ДНК, входящих в состав хроматина клеточных ядер.
На одном из тяжей ДНК (в месте ее раскручивания) по закону комплементарности (см. Генетический код) происходит сборка (синтез) информационных, или матричных, РНК (мРНК).
К фиксированным на рибосомах мРНК подходят транспортные рибонуклеиновые кислоты (тРНК), несущие на себе предварительно активированные аминокислоты, к-рые фиксируются на мРНК. Рядом располагаются такие аминокислоты, к-рые в синтезируемом белке должны быть соединены пептидной связью, чем обеспечивается специфическая первичная структура белков со строго определенным порядком следующих друг за другом аминокислот.
В свою очередь первичная структура предопределяет, если не полностью, то в значительной мере, пространственную конфигурацию, или третичную структуру, белков, в т. ч. и белков-ферментов.
Выпадение или нарушение какого-либо звена в сложном процессе биосинтеза фермента, осуществляющего определенную реакцию в обмене веществ, может привести к тяжелым патологическим нарушениям. Так, причиной многих наследственных болезней (см.) является выпадение синтеза всего лишь одного белка-фермента (напр., гидроксилазы при фенилпировиноградной олигофрении); «ошибка» в первичной структуре У α- или β-цепей гемоглобина, заключающаяся в замене всего лишь одной из 287 аминокислот, приводит к образованию патологических форм гемоглобина с нарушенной функцией присоединения и отдачи кислорода.
Фонд аминокислот используется также при синтезе других соединений.
Напр., биосинтез пуриновых нуклеотпдов (см. Пуриновые основания), начинающийся с рибозил-5-фосфата, проходит через многочисленные стадии и завершается образованием инозиновой к-ты (инозиновая к-та затем может подвергаться превращениям в адениловую и гуаниловую кислоты). При этом требуется участие глутамина (амида глутаминовой к-ты) в качестве источника азота в 3-м и 9-м положениях, глицина — в 7-м положении и углерода — в 4-м и 5-м положениях. Аспарагиновая к-та — источник азота в 1-м положении:

Атомы углерода (2-й и 8-й) доставляет формильное производное тетрагидрофолиевой к-ты, и, наконец, углерод на 6-м месте кольца пурина берется из бикарбоната. Эти данные представлены на схеме:
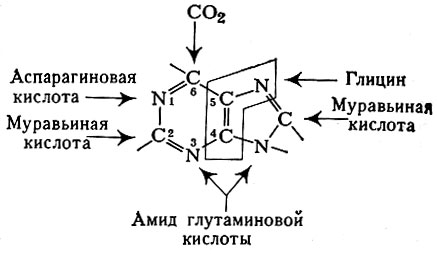
При последующем образовании адениловой к-ты (см. Аденозинфосфорные кислоты) вновь вовлекается аспарагиновая к-та, азот к-рой обеспечивает аминогруппу, стоящую при 6-м углеродном атоме пуринового кольца. При синтезе гуаниловой кислоты (см.) аминогруппа при 2-м углеродном атоме берется из глутамина.
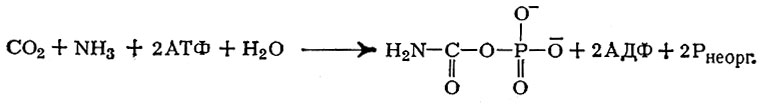
Синтез пиримидинов начинается с образования богатого энергией соединения — карбамилфосфата:

из аммиака (NH3), бикарбоната (НСО3-), аденозинтрифосфата (АТФ) как источника энергии и, наконец, N-ацетилглутаминовой к-ты в качестве активатора:
Карбамильная группа карбамилфосфата ферментативно переносится на аспарагиновую к-ту. Через образовавшуюся карбамиласпарагиновую к-ту, дигидрооротовую и оротовую кислоты (рис. 2) образуется оротидиловая к-та, переходящая в уридиловую к-ту и уридинтрифосфат (УТФ). Путем аминирования УТФ образуется цитидинтрифосфат (ЦТФ), причем эта последняя реакция представляет собой регулируемый процесс по закону обратной связи: ЦТФ тормозит образование карбамиласпарагиновой к-ты, а АТФ снимает это торможение. Т. о., образование пиримидиновых нуклеотидов, входящих в состав нуклеиновых кислот, регулируется соотношением содержания ЦТФ и АТФ.
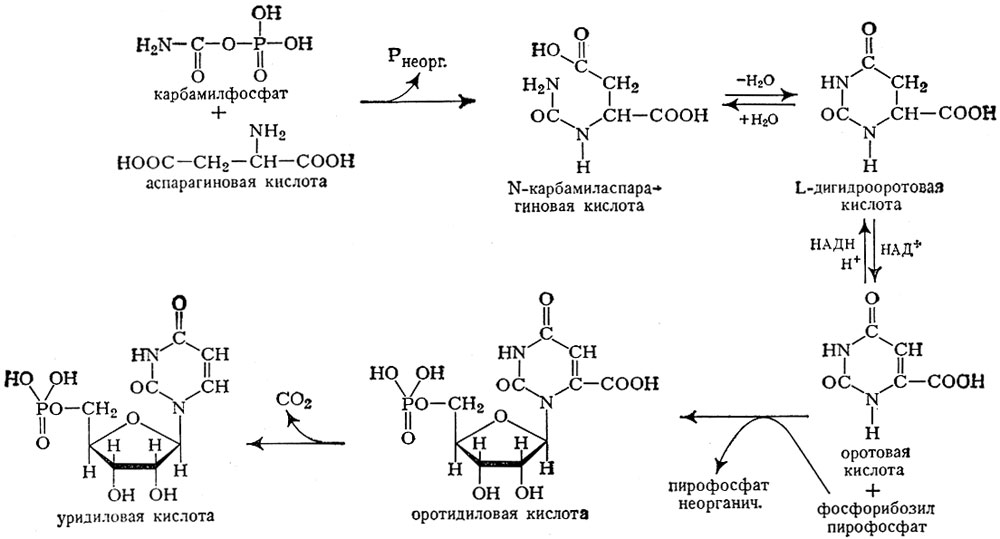
Рис. 2. Схема биосинтеза пиримидиновых оснований
Помимо образования пуриновых и пиримидиновых нуклеотидов, аминокислоты участвуют в образовании многих других физиологически важных соединений.
1. Из триптофана (α-амино-β-индолпропи оновой к-ты):
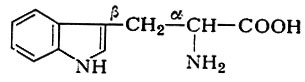
в результате ряда последовательных ферментативных превращений образуется никотиновая к-та, выполняющая функцию антипеллагрического витамина и участвующая в виде никотинамида
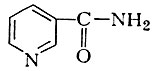
в биосинтезе никотпнамидных коферментов НАД и НАДФ.
2. Простейшая аминокислота глицин (CH2NH2COOH), помимо участия в образовании пуринов, обеспечивает весь азот и ряд атомов углерода при биосинтезе порфиринов, составляющих структурную основу желчных пигментов и небелковой части (простетической группы) железосодержащих хромопротеидов (см.).
Глицин выполняет также роль акцептора амндиновой группы аргинина при синтезе гуанидинуксусной к-ты, N-метилпронзводное к-рой — креатин (см.)
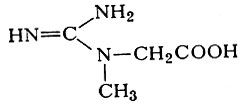
является важной составной -частью скелетной мускулатуры, сердца и мозга, а в виде фосфорилированного продукта (фосфокреатина) обеспечивает резерв богатых энергией фосфорных соединений, необходимых для функциональной активности ткани.
3. Серин
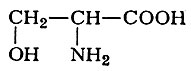
участвует в образовании сложного аминоспирта — сфингозина (см. Сфингозины), входящего в состав сфингомиелина (см. Сфинголипиды) — липида, особенно богато представленного в составе мозга и нервной ткани.
Серии участвует также в синтезе кофермента (см.) ацетилирования (КоА), ацилпроизводные к-рого представляют активную форму жирных кислот (см. Жировой обмен), участвующих в различных процессах биосинтеза и окислительного распада.
| Таблица 2. Некоторые биологически важные азотистые вещества, образующиеся из аминокислот | |
| Аминокислота | Вещество, предшественником которого являются аминокислоты |
| Аргинин | Спермин, спермидин, путресцин |
| Гистидин | Гистамин, эрготионеин |
| Лизин | Кадаверин, анабазин, кониин |
| Тирозин | Адреналин, норадреналин, меланин, тироксин, мескалин, тирамин |
| Триптофан | Серотонин, индол, скатол |
В табл. 2 представлены дополнительные сведения об отдельных аминокислотах, являющихся предшественниками нек-рых других биологически важных азотистых соединений.
Функциональные группы аминокислот широко вовлекаются в различные реакции обмена веществ.
Прежде всего это относится к аминогруппам, участвующим в реакции переаминирования (см.). Эта реакция, представляющая важнейший путь ферментативного превращения аминокислот, была открыта советскими биохимиками А. Е. Браунштейном и М. Г. Крицман в 1937 г. Она заключается в обратимом ферментативном переносе α-аминогруппы α-аминокислоты на α-углеродный атом α-кетокислоты без промежуточного освобождения аммиака.
В реакциях переаминирования, катализируемых различными трансаминазами, могут участвовать не только аминогруппы α-аминокислот, но и аминогруппы аминов и ω-аминокислот (напр., β-аланина, γ-аминомасляной к-ты); акцептировать аминогруппы могут не только α-кетокислоты, но и альдегиды (напр., малоновый или янтарный полуальдегиды).
Общая схема реакции переаминирования обычно изображается в следующем виде:

Непременным участником обратимой реакции ферментативного переаминирования, выполняющим коферментную функцию, является пиридоксальфосфат (I), а также пиридоксаминфосфат (II), оба — производные витамина В6 (пиридоксина).
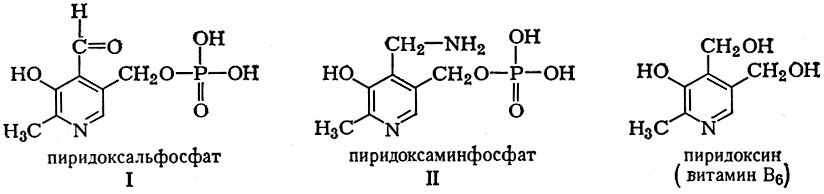
Пиридоксальфосфат принимает на себя аминогруппу аминокислоты и через стадии образования шиффовых оснований превращается в пиридоксаминфосфат (II), к-рый передает аминогруппу также через промежуточные стадии на кетокислоту, возвращаясь в первоначальное состояние (I).
Дикарбоновые аминокислоты — глутаминовая и аспарагиновая — наиболее активные участники процесса переаминирования. Под влиянием фермента глутаматдегидрогеназы осуществляется образование глутаминовой к-ты из аммиака и кетоглутаровой к-ты. Аминогруппа глутамиыовой к-ты широко транспортируется при участии аминофераз на различные α-кетокислоты и альдегиды, образуя новые аминокислоты и амины. Этим косвенным путем азот аммиака вовлекается в состав многочисленных азотистых органических веществ.
В биосинтезе ряда биологически активных соединений значительная роль принадлежит процессу метилирования. Перенос метильной группы, как правило, осуществляется аминокислотой — метионином в виде аденозилметионина, превращающегося после отдачи метильной группы в S-аденозилгомоцистеин (рис. 3).
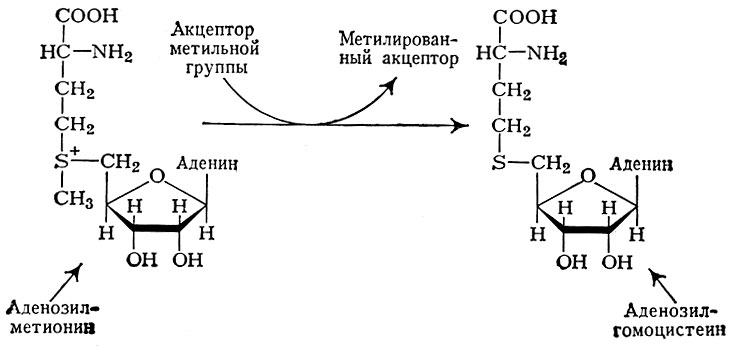
Рис. 3. Схема процесса метилирования
Акцепторы метильной группы разнообразны; к ним относятся: липиды, транспортные нуклеиновые кислоты, содержащие минорные (редкие) компоненты — метилированные нуклеотиды, гуанидинуксусную к-ту, никотинамид и др. Донорами метильных групп могут быть, помимо аденозилметионина, еще и холин, бетаины, N5-метилтетрагидрофолиевая к-та и др. (см. Метилирование).
|
|
|
|
|
Дата добавления: 2015-05-06; Просмотров: 2596; Нарушение авторских прав?; Мы поможем в написании вашей работы!