
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Статистическое толкование энтропии
|
|
|
|
Изменение энтропии в изопроцессах идеального газа
| Изохорный (V=const) | Изобарический (P=const) | Изотермический (T=const) | Адиабатический (S=const) |
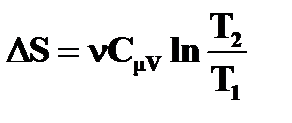
| 
| 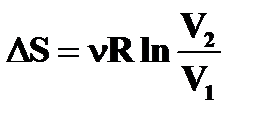
| 
|
Термодинамическая вероятность W состояния тела или системы – это число способов, которыми может быть реализовано данное конкретное термодинамическое состояние (макросостояние). Иначе говоря, это число всевозможных микрораспределений частиц по координатам и скоростям (микросостояний), которыми может быть осуществлено данное макросостояние.
В качестве примера рассмотрим сосуд, в котором находятся три молекулы 1, 2, 3. Эти молекулы могут по-разному распределяться между правой и левой половинами сосуда.
| ´1 ´3 ´2 | Возможные способы распределения этих молекул приведены в таблице. Здесь мы исходим из естественного предположения, что каждая молекула с равной вероятностью может находиться как в левой, так и в правой половине сосуда. Это следует из так называемого постулата равновероятности: в равновесной изолированной системе все микросостояния равновероятны. | |||||||||
| Молекулы, находящиеся слева | 1, 2, 3 | 1, 2 | 1, 3 | 2, 3 | ||||||
| Молекулы, находящиеся справа | 1, 2, 3 | 2, 3 | 1, 3 | 1, 2 | ||||||
| Номер макро-состояния | I | II | III | IV | ||||||
| Статистиче-ский вес | ||||||||||
Макросостояния определяются числом частиц в каждой половине сосуда. В нашем случае возможны четыре макросостояния: I, II, III и IV. Макросостояния характеризуются номерами частиц в каждой половине сосуда. Из таблицы видно, что макросостояниям I и II соответствует по одному микросостоянию. Статистический вес этих макросостояний равен 1. Статистический вес макросостояний III и IV равен 3, так как каждое из них может быть осуществлено тремя способами.
Таким образом, наибольшую термодинамическую вероятность или статистический вес имеют те макросостояния, в которых молекулы распределены по всему объему сосуда. Переход от порядка (все молекулы в одной части сосуда) к беспорядку (молекулы беспорядочно распределены по всему объему) повышает термодинамическую вероятность W состояния. Например, при движении с трением механическая энергия переходит во внутреннюю энергию, так как механическое движение упорядочено и обладает меньшей вероятностью, чем неупорядоченное тепловое движение молекул тела.
Следовательно, термодинамическая вероятность W является мерой беспорядка, мерой нестройности в системе.
Из сказанного следует, что наибольшей термодинамической вероятностью обладает равновесное состояние системы, состояние теплового равновесия. Поэтому если система, предоставленная самой себе, в некоторый момент времени не находится в состоянии равновесия, то наиболее вероятным будет ее приближение к равновесию. Если система перешла в состояние равновесия, то самопроизвольный переход ее в неравновесное состояние, строго говоря, не невозможен, но имеет подавляюще малую вероятность. В этом заключается природа необратимости тепловых процессов, которая проявляется в стремлении систем перейти в равновесное состояние.
Больцман сформулировал следующее утверждение: все процессы в природе протекают в направлении, приводящем к увеличению вероятности состояния.
Это утверждение носит название второго начала термодинамики и выражает статистический характер этого закона.
Формула Больцмана:
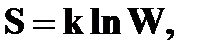
где k – постоянная Больцмана.
Энтропия системы определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние, т.е. энтропия является мерой неупорядоченности системы: чем больше микросостояний, реализующих данное макросостояние, тем больше энтропия.
Принцип возрастания энтропии: все процессы в замкнутой системе ведут к увеличению её энтропии. В замкнутой системе процессы идут в направлении от менее вероятных состояний к более вероятным, до тех пор, пока вероятность состояния не станет максимальной. В состоянии равновесия – наиболее вероятного состояния системы – число микросостояний максимально, при этом максимальна и энтропия.
|
|
|
|
|
Дата добавления: 2015-05-06; Просмотров: 447; Нарушение авторских прав?; Мы поможем в написании вашей работы!