
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон сохранения массы веществ
|
|
|
|
Закон эквивалентов.
Закон Авогадро,
Закон простых объемных отношений,
Закон кратных отношений,
Закон постоянства состава,
Закон сохранения массы веществ,
Теоретическая часть.
Показатели сетевого общества в отдельных странах
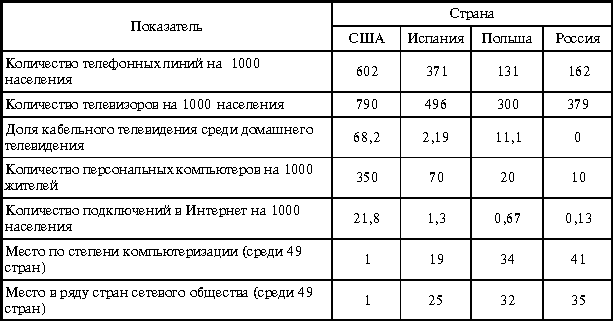
Источник: Мир России, 2000, №1.

В постиндустриальном обществе движущей силой нововведений и политики являются знания, а ключом к будущему – технологии.
[1] Обобщенное название полицейских сил, судебной и пенитенциарной системы (от англ. coercion - принуждение, подавление).
Стехиометрия - раздел химии, в котором рассматриваются количественные, массовые или объемные отношения между реагирующими веществами.
Основу стехиометрии составляют следующие стехиометрические законы:
Закон сохранения массы веществ был сформулирован и экспериментально подтвержден М. В. Ломоносовым в 1748 году.
В настоящее время он формулируется следующим образом:
общая масса веществ, вступающих в химическую реакцию, равна общей массе веществ, получающихся в результате реакции.
С точки зрения атомно-молекулярного учения, этот закон объясняется следующим образом: масса веществ является суммой масс составляющих их атомов. Так как при химических реакциях сами атомы не меняются и не меняется их общее количество, то сохраняется постоянной и соответствующая им общая масса.
Например:
СаO + СО2 = СаСО3
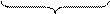 56 г 44 г 100 г
56 г 44 г 100 г
100 г
Cu(OH)2 = CuO + Н2О
98 г 80г 18г
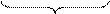 98 г
98 г
Закон сохранения массы вещества является частным случаем более общего закона природы - закона сохранения материи и движения:
|
|
|
|
|
Дата добавления: 2015-05-06; Просмотров: 463; Нарушение авторских прав?; Мы поможем в написании вашей работы!