
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. Эквиваленты простых и сложных веществ
|
|
|
|
Например.
Эквиваленты простых и сложных веществ
Эквиваленты и молярные массы эквивалентов.
| Элемент или сложное вещество | Эквивалент, Э, [ - ] | Молярная масса (М экв.) эквивалента,[г/моль] |
| Элемент Например, Са | Ээл = 1∙ f =1/В Э (Ca) = 1/2 | Мэкв = M ∙ f = M /В М(½Ca) = 40/2 = = 20 г/моль |
| Кислота Например, H2S | Э кислоты = 1∙ f = = 1/основность Э кислоты = 1∙ f = =1/основность | Мэкв = M ∙ f = M / основность М(½Н2S).=34 ∙ 1/2 = = 17 г/моль |
| Основание Например, Са(OH)2 | Эосн = 1 ∙ f = = 1/кислотность Э [Ca(OH)2] = 1/2 | Мэкв = M ∙ f = = M/кислотность М[½Ca(OH)2] = = 74 / 2 = 37 г/моль |
| Соль Например, Al2S3 | Эсоли = 1∙ f = 1 / n ∙ В = = Э [Al2S3] = 1/2 ∙ 3 = 1/6 | Мэкв = M ∙ f = = M / n ∙ В М(1/6 Al2S3) = = 150 / 6 = 25 г/моль |
Эквивалент и молярная масса эквивалента сложного вещества определяются конкретной реакцией, в которой участвует данное вещество.
Чему равен эквивалент и молярная масса эквивалента серной кислоты в реакциях с раствором щелочи, если образуется:
а) NаНSО4 и б) Nа2SО4?
а) В реакции с образованием гидросульфата натрия серная кислота нейтрализуется не полностью:
Н2SО4 + NаОН = NаНSO4 + Н2О.
В этой реакции серная кислота проявляет основность равную 1. Из этого следует, что фактор эквивалентности этой кислоты в данной реакции равен 1. Найдем значение эквивалента кислоты в данной реакции:
Э (H2SO4) =1∙ f = 1/основность = 1.
Найдем значение молярной массы эквивалента кислоты:
Мэкв (H2SO4) =M ∙ f = M/основность = 98/1 = 98 г/экв,
б) Сульфат натрия образуется при полной нейтрализации кислоты:
Н2SО4 + 2NаОН = Na2SO4 +2Н2О.
В этой реакции основность, проявляемая Н2SO4, равна 2 и значение фактора эквивалентности в этом случае равно 2.
Отсюда:
Э (H2SO4) =1 ∙ f = 1/основность = 1/2 моль,
Мэкв (½H2SO4) = M/основность = 98/2= 49 г/моль.
Для газообразных веществ удобно пользоваться понятием молярный объем эквивалента (V экв ).
Молярный объем эквивалента представляет собой объем одного моль эквивалентов газообразного вещества при нормальных условиях. Размерность молярного объема эквивалента [л/моль].
Так, 1 моль эквивалентов водорода (один моль атомов Н) имеет массу 1 г. Используя следствие из закона Авогадро, нетрудно рассчитать объем, занимаемый одним эквивалентом водорода.
1 моль молекул Н2 имеет массу 2 г и занимает объем 22,4 л, а объем, занимаемый одним эквивалентом водорода (одним моль атомов элемента водорода), который имеет массу 1 г, найдем из пропорции:
2 г Н2 → 22,4 л
1 г Н2 → х л
x = 11,2 л, т.е. V экв (H) =11,2 л/моль.
Аналогично можно рассчитать молярный объем эквивалента для кислорода, который будет равен:
V экв (½O) = 5,6 л/моль.
Введение в химию понятия «эквивалент» позволило сформулировать закон, называемый законом эквивалентов (И. Рихтер.). В современной трактовке закон гласит:
массы реагирующих друг с другом веществ пропорциональны молярным массам их эквивалентов.
Закон эквивалентов можно записать в следующем виде:
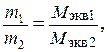
где m 1 и m 2 - массы взаимодействующих веществ; М экв.1 и М экв.2 - молярные массы эквивалентов.
Если вещества находятся в газообразном состоянии, удобно пользоваться понятием «молярный объем эквивалента» и следующей формулировкой закона эквивалентов:
|
|
|
|
|
Дата добавления: 2015-05-06; Просмотров: 468; Нарушение авторских прав?; Мы поможем в написании вашей работы!