
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Растворы электролитов
|
|
|
|
Растворы электролитов
Задача 1. Вычислить значение рН водного раствора хлорноватистой кислоты HClO с молярной концентрацией 0,005 моль/л, содержащего также гипохлорид натрия NaClO в концентрации 10−3 моль/л (степень диссоциации соли составляет 90%).
Решение. Согласно значению константы кислотности хлорноватистой кислоты K а = 2,8∙10−8, HClO является слабым электролитом и диссоциирует по уравнению
HClO ⇄ H+ + ClO−.
В присутствии соли NaClO положение равновесия диссоциации кислоты, в соответствии с принципом Ле Шателье, сместится в сторону образования HClO в результате появления в растворе гипохлорид-анионов ClO− за счет диссоциации сильного электролита:
NaClO → Na+ + ClO−.
При этом процесс диссоциации слабой кислоты будет подавлен, равновесная концентрация ионов водорода уменьшится и составит x моль/л. Так как ClO− образуются вследствие диссоциации обоих электролитов, то их общая концентрация в растворе составляет
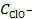 = x + α NaClO ∙ C NaClO = (x + 0,9∙10−3) моль/л.
= x + α NaClO ∙ C NaClO = (x + 0,9∙10−3) моль/л.
Концентрация же недиссоциированной кислоты составит (0,005 – x) моль/л.
Подставим равновесные концентрации H+, ClO− и HClO в выражение константы диссоциации хлорноватистой кислоты и рассчитаем значение концентрации ионов водорода
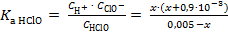 = 2,8∙10−8
= 2,8∙10−8
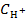 = 1,55∙10−8 моль/л.
= 1,55∙10−8 моль/л.
Для слабых электролитов величину водородного показателя раствора можно вычислить по формуле рН = −lg 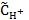 = −lg(1,55∙10−8) = 7,8.
= −lg(1,55∙10−8) = 7,8.
Таким образом, среда в растворе кислоты с добавлением ее соли является не слабокислотной, а слабощелочной, что обусловлено, помимо подавления диссоциации HClO, еще и гидролизом соли NaClO по аниону.
Задача 2. Рассчитать значение рН раствора, полученного смешением 100 мл сантимолярного раствора азотной кислоты HNO3 и 200 мл миллимолярного раствора гидроксида бария Ba(OH)2.
Решение. При смешивании водных растворов азотной кислоты и гидроксида бария происходит реакция нейтрализации
2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O
В результате нее образуется соль нитрат бария Ba(NO3)2, анион и катион которой обладают слабым поляризующим действием на молекулы воды. Поэтому данная соль в водных растворах практически не гидролизована, и рН раствора, полученного после реакции нейтрализации, будет определяться тем исходным электролитом, который взят в избытке.
Рассчитаем число моль эквивалентов HNO3 и Ba(OH)2, содержащихся в исходных растворах по формуле
n э = С э Vz,
где С э –молярная концентрация эквивалента (моль/л), V – объем раствора (л), z – число эквивалентности
n э (HNO3) = 10−2∙100∙10−3∙1 = 10−3 моль
n э (Ba(OH)2) = 10−3∙200∙10−3∙2 = 4∙10−4 моль
Согласно закону эквивалентов, азотная кислота дана в избытке, и по окончании реакции нейтрализации раствор будет содержать 6∙10−4 моль эквивалентов HNO3 и 4∙10−4 моль эквивалентов Ba(NO3)2.
Вычислим молярные концентрации ионов в полученном после смешения электролитов растворе. Так как азотная кислота и нитрат бария в водных растворах являются сильными электролитами, то в соответствии с уравнением диссоциации
HNO3 → H+ + NO3−
Ba(NO3)2 → Ba2+ + 2NO3−,
концентрации ионов можно рассчитать на основании концентрации этих электролитов по формуле
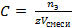 ,
,
что составляет
C (H+) = 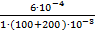 = 2∙10−3 моль/л
= 2∙10−3 моль/л
C (Ba2+) = 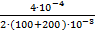 = 6,67∙10−4 моль/л
= 6,67∙10−4 моль/л
C (NO3−) = C (H+) + 2 C (Ba2+) = 2∙10−3 + 2∙6,67∙10−4 = 3,33∙10−3моль/л.
Для концентрированных растворов сильных электролитов, согласно первому приближению Дебая-Хюккеля, при расчете водородного показателя рН следует учитывать коэффициенты активности ионов g, которые зависят от ионной силы раствора I:
I = 0,5 å(Ci ∙ zi 2) = 0,5 ∙ (2∙10−3 ∙ 12 + 6,67∙10−4 ∙ 22 + 3,33∙10−3 ∙ 12) = 7,99∙10−3,
−lg 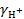 » 0,5 zi 2 ∙
» 0,5 zi 2 ∙  = 0,5∙ 12∙
= 0,5∙ 12∙  = 0,0446 или
= 0,0446 или 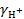 = 0,902
= 0,902
где Ci − молярная концентрация i -го иона, zi − заряд i -го иона.
Тогда величина рН равна рН = −lg 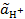 = −lg
= −lg 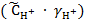 = −lg(2∙10−3∙ 0,902) = 2,74.
= −lg(2∙10−3∙ 0,902) = 2,74.
Задача 3. Расчетами доказать, будет ли образовываться осадок Ag2SO4 при смешивании 20 мл 5,0·10−4 М раствора нитрата серебра AgNO3 и 30 мл 1,0·10−7 М раствора сульфата натрия Na2SO4. Степень диссоциации веществ AgNO3 и Na2SO4 принять равной 100%.
Решение. Условием выпадения осадка при проведении реакции в растворе является превышение произведения концентрации ионов в конечном объеме смеси (ПK) в соответствии со стехиометрическими коэффициентами над величиной произведения растворимости (ПР).
При смешении растворов сильных электролитов (на что указывает значение степени диссоциации) AgNO3 и Na2SO4 может протекать реакция с образованием малорастворимого Ag2SO4
2AgNO3 + Na2SO4 → Ag2SO4 ↓+ 2NaNO3,
и при этом объем образовавшейся системы составляет
V смеси = V р-ра (AgNO3) + V р-ра (Na2SO4) = 20 + 30 = 50 мл
В соответствии с установившемся положением равновесия в насыщенном растворе труднорастворимого электролита Ag2SO4, выражение произведения растворимости имеет вид:
ПР (Ag2SO4) = [Ag+]2·[SO42−] = 1,2·10−5.
Тогда выражение произведения концентрации ионов
ПK = 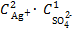 .
.
Так как соли AgNO3 и Na2SO4 являются сильными электролитами со степенью диссоциации 100%, то молярная концентрация Ag+ в растворе AgNO3 составляет 5·10−4 моль/л
AgNO3 → Ag+ + NO3− ,
5·10−4 5·10−4 5·10−4
а концентрация SO42− в растворе Na2SO4 − 10−7 моль/л
Na2SO4 → 2Na+ + SO42−
10−7 2·10−7 10−7
Рассчитаем концентрации ионов Ag+ и SO42− в смеси двух растворов:
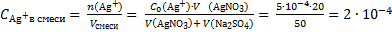 моль/л
моль/л
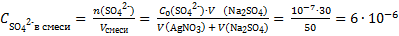 моль/л
моль/л
и подставим эти значения в выражение для расчета ПK = (2·10−4)2·6·10−6 = 2,4·10−13. Данное значение меньше ПР, следовательно, осадок Ag2SO4 не выпадет.
Задача 4. Вычислить значение рН раствора ацетата натрия CH3COONa, полученного при растворении 4,1 г безводной соли в воде, если объем полученного раствора равен 100 см3. K дисс(СН3СООН) = 1,75∙10–5, 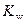 = 10–14
= 10–14
Решение. Вычислим молярную концентрации ацетата натрия в полученном водном растворе:
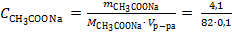 = 0,5 моль/л
= 0,5 моль/л
Соль CH3COONa образована сильным основанием NaOH и слабой кислотой CH3COOН (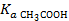 = 1,8∙10–5), поэтому гидролизуется по аниону согласно сокращенному ионно-молекулярному уравнению:
= 1,8∙10–5), поэтому гидролизуется по аниону согласно сокращенному ионно-молекулярному уравнению:
СН3СОО− + Н2О ⇄ СН3СООН + ОН−
Найдем значение константы гидролиза по формуле
K г = 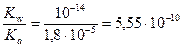 .
.
Так как имеет место быть гидролиз по аниону, то
рН = 14 + 0,5lg(K г∙ C) = 14 + 0,5lg(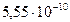 ∙ 0,5) = 9,22.
∙ 0,5) = 9,22.
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 6432; Нарушение авторских прав?; Мы поможем в написании вашей работы!