
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Написать уравнения диссоциации этих соединений в водных растворах
|
|
|
|
Определить заряд комплексного иона, степень окисления и координационное число комплексообразователя в каждом из соединений
УРОВЕНЬ В
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Так как приведенная реакция является окислительно-восстанови-тельной, то
НОК ДМ
Полное ионное уравнение.
Протекающей при стандартных условиях.
Рассчитать константу равновесия в реакции цементации
CuSO4(р-р) + Fe(к) < = > FeSO4(р-р) + Cu(к),
| Дано: Уравнение реакции | Решение Записываем реакцию в ионном виде: |
| Кс –? |
Feo(к) + Cu+2(р-р) + SO 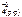 <=> Fe+2(р-р) + SO
<=> Fe+2(р-р) + SO 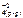 + Cuo(к)
+ Cuo(к)
Cu+2(р-р) + Feo(к) < = > Fe+2(р-р) + Cu0(к) – сокращенное ионное уравнение
окис-ль Сu+2 + 2ē = Cu 1  = 0,34 В (см. табл. 11.1)
= 0,34 В (см. табл. 11.1)
восст-ль Fe0 – 2ē = Fe+2 1  = –0,44 В (см. табл. 11.1)
= –0,44 В (см. табл. 11.1)
Cu+2 + Fe0 = Cu0 + Fe+2
ε0 =  –
–  ; ε0 = 0,34 – (–0,44) = 0,78 В.
; ε0 = 0,34 – (–0,44) = 0,78 В.
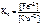 .
.
 =
= 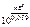 ,
,
где n – НОК.
 =
= 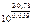 = 1026
= 1026
Высокое значение Кс свидетельствует о прктически полном смещении равновесия вправо.
Ответ: Кс = 1026
K4[Mo(CN)8], [PtCl4(NH3)2].
| Дано: K4[Mo(CN)8], [PtCl4(NH3)2] Заряд комплексного иона –? | Решение: Диссоциация комплексных соединений протекает с отщеплением ионов внешней сферы по типу диссоциации сильных электролитов: K4[Mo(CN)8] = 4К+ + [Mo(CN)8]4-. |
| Ме n + –? кч –? |
Заряд комплексного иона [Mo(CN)8]4- равен суммарному заряду ионов внешней сферы, но противоположен ему по знаку.
Вторичная диссоциация комплексного иона обратима и протекает по типу диссоциации слабого электролита:
[Mo(CN)8]4- <=> Мо х + 8 CN-.
Степень окисления комплексообразователя (х) определяется по заряду комплексного иона:
х
[Mo(CN)8] 4-.
х + 8·(–1) = –4, откуда х = + 4, т.е. заряд комплексообразователя Мо4+.
Координационное число комплексообразователя (Мо4+) равно суммарному числу лигандов (CN-), окружающих комплексообразователь, т.е.  = 8.
= 8.
Так как соединение [PtCl4(NH3)2] не содержит внешней сферы, то его заряд равен нулю (неэлектролит) и для него наблюдается только вторичная диссоциация:
[Pt(NH3)2Cl4]0 <=> Рt x + 2NH 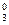 + 4Cl-.
+ 4Cl-.
x + 2 · 0 + 4 · (–1) = 0, x = +4,
т.е. заряд комплексообразователя Рt4+, а 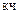 Pt4+ = 6.
Pt4+ = 6.
Ответ: [Mo(CN)8]4-,[PtCl4(NH3)2]0; Мо4+, Pt4+;  = 8;
= 8; 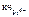 = 6.
= 6.
2.Константы нестойкости комплексных ионов [Fe(CN)6]4- и [Fe(CN)6]3- соответственно равны 1·10-37 и 1·10-44. Написать выражения констант нестойкости этих ионов и рассчитать константы их устойчивости. Какой из комплексных ионов является более прочным?
| Дано: [Fe(CN)6]4- [Fe(CN)6]3- | Решение Диссоциация комплексных ионов – процесс обратимый и количественно характеризуется константами нестойкости. [Fe(CN)6]4- <=> Fe2+ + 6CN-; |
 –? –?
 –? –?
|
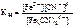 = 1·10-24;
= 1·10-24;
[Fe(CN)6]3- <=> Fe3+ + 6CN-;
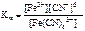 = 1·10-3.
= 1·10-3.
Константы устойчивости – константы равновесия обратных процессов (образования комплексных ионов).
Fe2+ + 6CN- <=> [Fe(CN)6]4-;
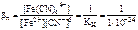 = 1024;
= 1024;
Fe3+ + 6CN- <=> [Fe(CN)6]3-;
 = 1031.
= 1031.
Значение константы устойчивости комплексного иона [Fe(CN)6]3- больше константы устойчивости комплексного иона [Fe(CN)6]4-. Значит, комплексный ион [Fe(CN)6]3- более прочный.
Ответ: комплексный ион [Fe(CN)6]3- более прочный.
3. Составить формулы следующих комплексных соединений с координационным числом платины (IV), равном шести: PtCl4·6NH3; PtCl4·4NH3; PtCl4·2NH3. Написать уравнения диссоциации этих солей в водном растворе и назвать их.
| Дано: PtCl4·6NH3 PtCl4·4NH3 PtCl4·2NH3 | Решение В состав внутренней сферы включается шесть лигандов. В первую очередь – молекулы аммиака и затем до координационного числа шесть – ионы хлора. Остальные ионы хлора образуют внешнюю сферу. |
| Комплексные соединения –? |
PtCl4·6NH3 → [Pt(NH3)6]Cl4 = [Pt(NH3)6]4+ + 4Cl-;
[Pt(NH3)6]4+ <=> Pt4+ + 6NH3;
PtCl4·4NH3 → [Pt(NH3)4Cl2]Cl2 = [Pt(NH3)4Cl2]2+ + 2Cl-;
[Pt(NH3)4Cl2]2+ <=> Pt4+ + 4NH3 + 2Cl-;
PtCl4 ·2NH3 → [Pt(NH3)2Cl4] <=> Pt4+ + 2NH3 + 4Cl-;
[Pt(NH3)6]Cl4 – хлорид гексаамминплатины (IV);
[Pt(NH3)4Cl2]Cl2 – хлорид дихлоротетраамминплатины (IV);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина
Дано:
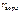 = 200 л
Ж = 9 ммоль/л = 200 л
Ж = 9 ммоль/л
| Решение
Ж =  , ,
|
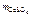 –? –?
|
Дано:
 = 2,5 м3
Жобщ = 13,6 ммоль/л = 2,5 м3
Жобщ = 13,6 ммоль/л
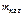 = 1 кг = 1 кг
| Решение Обменная емкость катионита (ε) – максимальное количество ионов (ммоль), поглощаемое 1 г катионита обменным путем (ммоль/г). |
| ε –? |
|
|
|
|
|
Дата добавления: 2015-03-31; Просмотров: 650; Нарушение авторских прав?; Мы поможем в написании вашей работы!