
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Написать уравнения электродных процессов и суммарной реакции процесса коррозии
|
|
|
|
Или
НОК ДМ
Или
Решение
Тогда
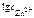 =
=  = 0,338.
= 0,338.
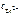 = 100,339 моль/л = 2,18 моль/л
= 100,339 моль/л = 2,18 моль/л
Ответ: 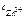 = 2,18 моль/л.
= 2,18 моль/л.
2.Составить две схемы гальванических элементов (ГЭ), в одной из которых олово служило бы анодом, в другой – катодом. Для одной из них написать уравнения электродных процессов и суммарной токообразующей реакции. Вычислить значение стандартного напряжения ГЭ.
В гальваническом элементе анодом является более активный металл с меньшим алгебраическим значением электродного потенциала, катодом – менее активный металл с большим алгебраическим значением электродного потенциала.
По табл. 11.1 находим  = –0,14 В.
= –0,14 В.
а) Олово является анодом ГЭ.
В качестве катода можно выбрать любой металл с 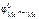 >
> 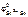 .
.
Выбираем медь 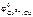 = + 0,34 В. В паре Sn–Cu олово будет являться анодом ГЭ, медь – катодом. Составляем схему ГЭ:
= + 0,34 В. В паре Sn–Cu олово будет являться анодом ГЭ, медь – катодом. Составляем схему ГЭ:
А(-) Sn │ Sn2+ ││ Cu2+ │ Cu(+)K
А(-) Sn │ SnSO4 ││ CuSO4 │ Cu(+)K.
Уравнения электродных процессов:
На A(-) Sn – 2ē = Sn2+ 1 – окисление
На К(+) Cu2+ + 2ē = Cu 1 – восстановление
Sn + Cu2+ = Sn2+ + Cu – суммарное ионно-молекулярное уравнение токообразующей реакции;
Sn + CuSO4 = SnSO4 + Cu – суммарное молекулярное уравнение токообразующей реакции.
Рассчитываем стандартное напряжение ГЭ:
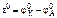 =
= 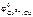 –
– 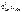 = +0,34 – (–0,14) = 0,48 В.
= +0,34 – (–0,14) = 0,48 В.
б) Олово является катодом ГЭ.
В качестве анода ГЭ можно выбрать любой металл с 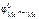 <
< 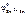 , кроме щелочных и щелочноземельных металлов, так как они реагируют с водой.
, кроме щелочных и щелочноземельных металлов, так как они реагируют с водой.
Выбираем магний 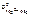 = –2,37 В.
= –2,37 В.
В паре Mg–Sn магний является анодом, олово – катодом.
Составляем схему ГЭ:
А(-) Mg │ Mg2+ ││ Sn2+ │ Sn(+)K
А(-) Mg │ MgSO4 ││ SnSO4 │ Sn(+)K.
3. Составить схему коррозионного гальванического элемента, возникающего при контакте железа с цинком:
а) в атмосферных условиях (Н2О + О2);
б) кислой среде (Н2SO4);
в) кислой среде в присутствии кислорода (HCl + O2).
|
|
|
|
|
Дата добавления: 2015-03-31; Просмотров: 4904; Нарушение авторских прав?; Мы поможем в написании вашей работы!