
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закончить уравнения реакций и уравнять их используя метод электронного баланса. Указать окислитель и восстановитель
|
|
|
|
УРОВЕНЬ В
РЕАКЦИИ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
а) Pb + HNO3 конц →
б) S + HNO3 конц →
в) P + H2SO4 конц →
г) Mg + H2SO4 конц →
а) Металл + НNО3(конц) → соль + оксид азота + Н2О.
Формула оксида азота зависит от активности металла: N2O выделится, если в реакцию вступает активный металл (стоящий в ряду стандартных электродных потенциалов в интервале Li...Al);
NО выделится, если в реакцию вступает металл средней активности (Mn–Рb);
NO2 выделится, если в реакцию вступает малоактивный металл (стоящий в ряду стандартных электродных потенциалов после водорода).
| Дано: а) Pb + HNO3 конц → S + HNO3 конц → б) P + H2SO4 конц → Mg + H2SO4 конц → | Решение а) Pb0 + HN+5O3 конц = восст. окисл. = Pb+2(NO3)2 + N+2O + H2O НОК ДМ восстановитель Pb0 – 2ē = Pb+2 3 окислитель N+5 + 3ē = N+2 2 3Pb0 + 2N+5 = 3Pb+2 + 2N+2 |
| Уравнять реакции и указать окислитель и восстановитель |
Переносим полученные коэффициенты в молекулярное урав-нение:
3Pb0 + 2HN+5O3(конц) = 3Pb+2(N+5O3)2 + N+2O + H2O.
Поскольку азотная кислота расходуется не только на получение 2 моль NO, но и на получение 3 моль Pb(NO3)2, в которых содержится 6NO 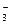 со степенью окисления N+5, то для протекания этого процесса необходимо дополнительно 6 моль HNO3:
со степенью окисления N+5, то для протекания этого процесса необходимо дополнительно 6 моль HNO3:
 6HNO3 (конц) + 3Pb0 + 2HNO3(конц) = 3Pb(NO3)2 + 2NO + H2O
6HNO3 (конц) + 3Pb0 + 2HNO3(конц) = 3Pb(NO3)2 + 2NO + H2O
Суммируем число моль HNO3 и уравниваем количество водорода и кислорода (4Н2О):
3Рb + 8HNO3(конц) = 3Pb(NO3)2 + 2NO + 4Н2О.
б) Неметалл + HNO3(конц) → кислота, в которой неметалл проявляет высшую степень окисления + NO2 + (Н2О):
B → H3B+3O3; P → H3P+5O4; S → H2S+6O4; Se → H2Se+6O4;
Si → H2Si+4O3; C → H2C+4O3; As → H3As+5O4.
|
|
|
|
|
Дата добавления: 2015-03-31; Просмотров: 1872; Нарушение авторских прав?; Мы поможем в написании вашей работы!